실험 방법
1) 실험에 사용될 TEOS, 물, HCl 용액을 부피(㎖)로 계산하였고, 에탄올은 99.0%이 없어서 95%에탄올을 99%로 감안하여 계산하였다.
2) 실험대에 핫플레이트 위에 물을 담은 수조의 온도를 50℃로 유지시키고, 삼구플라스크에 준비한 에탄올과 TEOS를 천천히 넣어주면서 비교적 산소와 접촉을 줄이기 위해 신속하게 넣었다.
3) 수조의 온도가 50℃ 로 된 후 삼구플라스크 한쪽은 온도계 가운데는 증류수를 조금씩 넣어 가수분해를 시키도록 장치하였고 나머지 한 부분은 HCl을 넣기 위해 막아놓았다.
4) 교반 도중에 공기와의 접촉을 피하기 위해 삼구플라스크 입구 쪽에 구리스와 parafilm으로 밀봉했다.
5) 교반을 시키면서 증류수를 한 방울씩 천천히 넣어 주도록 하였다. 5분이 지난 후에 HCl을 조금씩 넣어주고 다시 밀봉하였다. 그리고 약 1.5시간동안 반응이 되도록 두었다.
6) 반응이 끝나고 비커에 담아서 합성된 sol을 drying oven에 80℃에서 하루정도 건조시켰다.
실험 결과
1. Raw data
비커의 질량(g) | 85.8 |
비커 + SiO2의 질량(g) | 93.57 |
SiO2의 질량(g) | 7.77 |
SiO2 분자량 | 60.084g/㏖ |
2. 실험에 사용된 시약의 물리상수 및 부피(㎖)
종류 | 분자량(g/㏖) | ㏖e (%) | 사용몰수 | 밀도 |
TEOS | 208.3 | 6.7 | 0.134 | 0.93 |
EtOH | 46.07 | 25.8 | 0.516 | 0.79 |
H2O | 18 | 67.3 | 1.346 | 1 |
HCl | 36.5 | 0.2 | 0.004 | 1.20 |
3. 부피 계산
① TEOS : 208.3g/㏖ × 0.134㏖ × 100/98 × 1/0.93g/㎖ ≒ 30.63㎖
② EtOH : 46.07g/㏖ × 0.516㏖ × 100/95 × 1/0.794g/㎖ ≒ 31.52㎖
③ H2O : 18.00g/㏖ × 1.346㏖ × 100/100 × 1/1g/㎖ ≒ 24.2㎖
(24.2 - 22.14 = 0.417)-물의 양은 가수분해시 넣는 양을 빼서 계산
④ HCl : 36.5g/㏖ × 0.004㏖ × 100/35 × 1/1.20g/㎖ ≒ 0.35㎖
4. 수율 계산
Si(C2H5O)₄→ SiO₂+ 2O(C2H5)4
이론적 수율은 한계반응물 TEOS의 1/3
이론적 수득량 = 0.134 ㏖ (TEOS 와 증류수 의 반응비는 1:4이며, 여기서 한계반응물은 TEOS 이고, SiO2 의 생성몰수 역시 0.134㏖이다.
실험적 수득량 = 7.77g/1 × 1㏖/60.08g = 0.129㏖
수율 = 0.129㏖/0.134㏖ ×100% ≒96.3%
토의 사항
본 실험은 Sol-Gel법을 이용하여 구형의 SiO2를 제조하는데 목적이 있었다. 우선 TEOS와 EtOH를 담은 삼각플라스크에 증류수를 조금씩 가해주면서 가수분해하여 Si(OC2H5)4 + 2H2O → SiO2 + 4C2H5OH가 되고 다음 응축반응이 일어나고 Si(OH)4 → SiO2 + 2H2O 과정을 통해 SiO2 를 얻게 되었다.
실험에 쓰일 촉매로 인하여 구형의 SiO2 를 얻거나, 가지 형 SiO2 를 얻을 수 있다. 본 실험에선 구형 SiO2 를 얻기 위해 산 촉매(HCl)를 사용하였다. 삼구플라스크의 온도를 50℃ 로 유지하기 위해 핫플레이트 위의 항온수조의 물 온도를 50℃로 유지하고 물 중탕하였고, 가수분해를 하기 위해 삼구 플라스크의 가운데 입구에 dropping funnel을 설치하였다.
충분히 가수분해 시킨 후에 산 촉매로 쓰일 HCl을 조금씩 넣어주고 공기를 차단하기위해 parafilm과 구리스로 밀봉시켰다. 그 후에 1.5시간 교반하면서 반응을 시켰다. 실험 논문에 따르면 isopropanol (250 ㎚), ethanol (125 ㎚), methanol (5㎚)로 용매에 따라 그 크기가 달라짐을 알 수 있다.
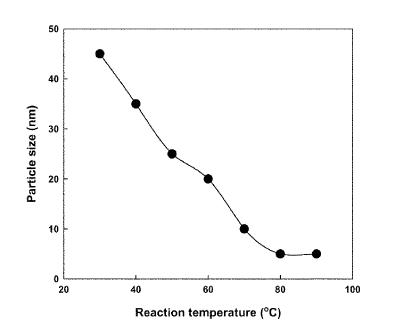 |
| 용매가 에탄올일 때의 온도에 따른 particle size |
위 그래프에 따르면, 본 실험처럼 용매로 에탄올을 사용 했을 때 온도가 높아짐에 따라 particle size가 점점 줄어드는 것을 볼 수 있다. 반응 온도가 50℃ 였고, 용매로 에탄올을 사용했으므로 대략 24~26㎚의 particle size를 얻을 수 있다는 것을 알 수 있다. 그럼으로 이것은 Sol-Gel 반응에 온도와 용매 그리고 촉매에 따라 영향이 미친다는 것을 보여준다.
24시간동안 80℃ oven에 건조 시킨 결과 (93.57)g이 나왔고 이론상 ()g 보다 ()g 부족한 수득률 %를 얻게 되었다.그에 대한 오차는 첫 번째로 실험에서 사용할 EtOH 99%용액이 부족하였고, 95%용액으로 그 양의 계산과정에 생긴 오차가 있을 수 있다. 두 번째는 밀봉이 잘 되지 않아 오차가 발생 했을 수도 있다. 그리고 , 시약을 다루는 과정에서 TEOS는 산소와 반응성이 좋기 때문에 오차를 발생 시켰을 수 있다. 특히 dropping funnel에서 증류수를 다 넣은 후 나중에 잠궜는데, funnel에 있는 산소와 반응이 되었을 수 있다. 본 실험에서 핫플레이트는 정밀한 온도 유지가 힘들기 때문에 실험 중간에 조금 아쉬운 부분이였다.
2. 결론
실험의 목적은 Sol-Gel 반응을 통해 SiO2 를 최종적으로 얻는 것이였다. Sol-Gel 과정은 이름이 의미하는 것처럼 콜로이드 부유상태(=sol)을 만들고 이 졸에 젤화 과정을 통해 액체상의 망상 조직(=gel)으로 변환 시켜 무기질 망상 조직으로 만드는 것을 말한다. 금속 알콕사이드로 TEOS(Tetraethyl Orthosilicate)를 사용하고 ETOH은 용매로서 H2O는 가수분해를 위해 사용되었다. 염산은 산 촉매로서 가지형 SiO2 를 얻기위해 사용되었다. 삼각플라스크의 온도를 수조의 온도를 50℃ 로 유지함으로써 일정하게 하였고, 가수분해를 위하여 가운데 입구에 dropping funnel을 설치하였다.
충분히 가수분해 시킨 후에 산 촉매로 쓰일 HCl을 조금씩 넣어주고 공기를 차단하기위해 parafilm과 구리스로 밀봉시켰다. 그 후에 1.5시간 교반하면서 반응을 시켰다. 본 실험처럼 용매로 에탄올을 사용 했을 때 온도가 높아짐에 따라 particle size가 점점 줄어드는 것을 볼 수 있다. 반응 온도가 50℃ 였고, 용매로 에탄올을 사용했으므로 대략 24~26㎚의 particle size를 얻을 수 있다는 것을 알 수 있다. 그럼으로 이것은 Sol-Gel 반응에 온도와 용매 그리고 촉매에 따라 영향이 미친다는 것을 보여준다.
실험 후 24시간동안 80℃ oven에 건조 시킨 결과 (7.77)g이 나왔고 이론상 (8.05)g 보다 (0.28)g 부족한 수득률 96.3%를 얻게 되었다. 이러한 차이가 나온 이유로는 실험에서 사용할 EtOH 99%용액이 부족하였고, 대체하여 사용될 95%용액으로 그 양의 계산과정에 생긴 오차가 있을 수 있다. 또한, 밀봉이 잘 않되어 오차가 발생 했을 수도 있고, 시약을 다루는 과정에서 TEOS는 산소와 반응성이 좋기 때문에 오차를 발생 시켰을 수 있다. 특히 dropping funnel에서 증류수를 다 넣은 후 나중에 잠궜는데, funnel에 있는 산소와 반응이 되었을 수 있며, 반응기 내 온도 유지가 잘 되지 못한 점도 오차의 원인이 라 할 수 있다.
참고 문헌
1. 공업화학 실험1, 전북대학교 환경화학공학부, 2009 p.37~44


!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글