실험 목적
여러 항생제를 이용하여 특정세균에 대한 감수성 평가를 해봄으로써 각 항생제에 대해 알아보고 임상적으로 적절한 항생제를 사용함으로써 항생제 오용 및 남용을 막을 수 있다.
실험 이론 및 원리
1. 화학요법의 원리
1) 정의
화학요법이란 병원미생물에 대하여 특이하게 작용하는 순수한 화학물질을 사용해서 질병을 치료하거나 예방하는 방법이다. 즉, 화학요법은 열 또는 강력한 소독약으로 미생물을 급속히 말살시키는 살균작용을 기대하는 것이 아니고, 미생물의 증식을 저해 또는 완전히 억제하는 병원성 미생물의 증식 저지작용(microbiostatic)을 주요 수단으로 동물체내에서 병원성 미생물을 박멸하는 것을 의미한다. 아울러 이와 같은 작용은 숙주의 조직에는 영향을 미치지 않아야 한다.
2) 일반적인 개념
(1) 항생제 (antibiotics)
미생물이 생산하는 대사산물로 소량으로 다른 미생물의 발육을 억제하거나 사멸시키는 물질
(2) 항균범위 (antibacterial spectrum)
항균제의 작용범위를 지칭하며 광범위(broad-spectrum)와 협소범위(narrow-spectrum)약물로 나눈다. 광범위 항균제는 보통 그람양성 및 음성균 모두에 효과를 나타내며 tetracyclinerP와 chloraphenicol을 들 수 있다. 이에 반해 협소범위 항균제인 penicillin G의 경우 주로 그람양성균에만 효과를 나타낸다.
(3) 항균효력 (antibacterial potency)
항균제의 mg당 항균작용을 표시하는 것으로 그 항균제에 예민한 미생물의 번식을 억제할 수 있는 최저저지농도(MIC)를 기초로 하여 표현한다.
3) 항생제의 작용기전
항생제 내성의 기전을 이해하려면 우성 약제의 작용 기전을 알아야 한다. 1920년에 처음 항생제가 발견된 이래로 그것들의 인체나 동물체내에서의 작용기전에 대한 연구가 꾸준히 진행되어왔다. 항생제가 세균에 대하여 작용을 하기 위해서는 다음의 조건들이 충족되어야 한다.
첫째, 세균 내에 항생제의 표적 분자(target molecule)가 있고, 적절한 농도의 항생제가 세균의 표적이 되는 부위로 침투가 가능하여야 하며, 둘째, 항생제가 표적분자와 만나 상호작용을 통하여 항균효과를 발휘할 수 있어야 하고, 셋째, 항생제가 세균의 세포내 혹은 세포외의 효소에 의하여 불활성화되는 것을 피하여야 한다.
이러한 전제 조건을 충족하면서 각 항생제는 서로 다른 기전을 통하여 항균효과를 나타내고 있다. 항생제가 항균효과를 나타내는 기전을 크게 5가지로 요약할 수 있는데, (1) 세균의 세포벽 합성의 억제 (2) 세포막 구조와 기능의 변화 (3) 단백합성의 억제 (4) 세균 대사의 억제 (5) 핵산 대사의 방해 등이다.
기 전 | 항 생 제 |
세포벽 합성의 저해 | β-lactam 항생제, Vancomycin |
세포막 기능과 구조의 억제 | Polymyxin B |
단백합성의 억제 | Aminogllycosides, Tetracyclines, Macrolides Clindamycin,Chloramphenicol |
세포 대사의 억제 | Sulfonamides, Trimethoprim |
핵산 대사의 억제 | Rifampin, Quinolones, Metronidazole |
표 1 항생제의 주요 작용 기전
우선 세균의 세포벽 합성을 억제함으로써 항균효과를 나타내는 대표적인 항생제가 β-lactam 제제와 vancomycin 이며, polymixin B 는 세포막의 구조와 기능에 영향을 미쳐 항균효과를 나타낸다. 세균의 단백합성을억제하는약제로는 aminoglycoside, tetracycline, macrolide, clindamycin, chloram-phenicol 등이 있고, 세균 대사의 억제는 sulfonamide 나 trimethoprim 이 대표적인 예이다. 반면, refampin, quinolone, metronidazole 등은 핵산 대사를 방해한다.
2. 항생제 내성의 발생 기전
항생제가 항균효과를 발휘하는데 필수적인 조건을 고려하면 이에 대한 세균의 내성 획득 기전을 이해할 수 있다. 우선 항생제의 표적분자는 대개 세균의 내부 깊숙한 곳에 있으므로 항생제가 세포벽을 뚫고 들어가 표적분자와 만나는 데까지 많은 장애가 존재할 수 있다. 따라서 세균은 세포벽이나 막의 투과성을 변화시켜 항생제의 침투 자체를 방해할 수 있다.
아울러 세포 내에서 항생제가 축적되는 것을 유출 기전(efflux)에 의하여 제한할 수도 있다. 두 번째로, 일단 항생제가 표적 분자와 만나서 상호작용을 하여야 항균효과가 나타나는데, 세균이 표적 분자를 변화시켜 이러한 상호작용을 방해할 수도 있다. 또는 세균이 항생제와 무관한 다른 대사 경로를 이용하여 생존하므로써 항생제의 주된 표적분자의 가치를 무력화시킬 수도 있다.
마지막으로 일잔 세포 내에 축적된 항생제를 불활성화시키는 효소를 생성하여 항생제에 대항하는 방법도 동원된다. 세균은 이러한 몇 가지 방법들 중 한 가지 혹은 두 가지 이상을 동원하여 효과적으로 항생제에 대항하게 되며, 여러 기전이 동원될수록 내성의 정도는 증가하게 된다.
약제의 종류 | 내성 기전 |
β-lactam항생제 | 페니실린 결합단백의 변화, 약제 침투의 감소, β-lactamase |
Aminogllycosides | 리보솜 결합의 저해, 약제 침투 및 축적의 저해, 약제 불활성화 효소 |
Macrolides | 리보솜 결합의 저해, 약제 침투 및 축적의 저해, 유출(efflux)기전 |
Chloramphenicol | 리보솜 결합의 저해, 약제 침투 및 축적의 저해, 유출(efflux)기전, Chloramphenicol acyltransferase |
Tetracyclines | 유출(efflux)기전, target(ribosome) resistance, 약제 불활성화 |
Quinolones | target(DNAgyrase) resistance, 약제 침투 및 축적 저해, 유출(efflux) 기전 |
Rifampin | RNA polymerase의 저하, 약제의 변화 |
표 2 주요 항생제와 내성 발생의 기전
1) 항생제의 세포 내 침투 및 축적의 방해
항생제가 세균을 공격하는 첫 번째 단계인 침투과정 및 세포 내 축적과정을 방해하여 항생제에 대항하는 방법이다. 침투 자체가 방해를 받아 내성이 발생하는 치료적인 약제는 β-lactam 제제이며, 세포내 축적의 방해는 aminoglycoside, 유출(efflux)기전에 의한 내성 발생은 tetracycline 제제가 대표적인 예이다.
2) 표적분자 (target molecules)의 변형으로 인한 내성
이 기전은 항생제가 작용하게 되는 표적이 되는 물질(혹은 분자)이 변형되어 항생제의 작용점이 없어지게 되어 내성이 획득되는 방법이다.
β-lactam 항생제를비롯하여 glycopeptide, amino glycoside, macrolide, chloramphenicol, tetracycline, quinolone 등에 대한 내성 발현이 이 기전에 의한다.
3) 항생제의 불활성화(inactivation)를 통한 내성
일단 항생제가 세포 내에 침투하여 표적 분자와 상호 작용을 하고, 균체 내에 축적이 되면 항균효과를 발휘할 수 있게 된다. 그러나 이 단계에서도 세균은 항생제에 대항하기 위하여 다른 기전의 내성을 발현하게 된다. 이는 항생제를 불활성화시키는 효소 등을 생성하는 과정으로 이루어진다.
3. 항생제 감수성 검사
1) 종류
(1) 액체배지 희석법 (broth dilution method)
기초배지로 Muller-Hinton 한천이 흔히 사용된다. 균주는 Steers replicator로 접종한다. 한꺼번에 균주 30주 이상의 감수성을 시험할 수 있다. 집락의 증식 상태를 눈으로 확인할 수 있기 때문에 다른 세균에 의한 오염을 배제할 수 있는 장점이 있다. 그러나 이 방법은 통상적인 감수성 시험에 사용하기에는 너무 번거롭고, 비용이 많이 드는 단점이 있으며, 흔히 연구용으로 사용된다.
(2) 한천배지 희석법 (agar dilution method)
액체배지를 기초배지로 사용한다. 항균제 농도마다 1㎖ 이상의 액제배지를 사용하면 macrobroth 희석법, 0.05-0.1㎖를 사용하면 microbroth 희석법이라 부른다. MIC 뿐 아니라 최소살균농도 (minimal bactericidal concentration, MBC)도 측정할 수 있는 장점이 있다. 그러나 집락의 증식 상태를 눈으로 확인할 수 없기 때문에 다른 세균에 의한 오염을 배제할 수 없는 단점이 있다.
Microscan, Vitek 등 자동화된 장비는 microbroth 희석법으로 균주의 MIC를 측정하며, 많은 미생물 검사실에서 이들 자동화 장비를 이용해서 편리하게 항균제 감수성 시험을 하고 있다. 그러나 이들 자동화 장비는 감수성, 중간내성 및 내성을 구분하는 breakpoint 만 시험할 수 있는 경우가 많으며, 따라서 진정한 의미의 MIC 시험이라고 하기는 어렵다. 또한 항균제의 MIC 보고가 감수성 양상 (감수성, 중간내성 및 내성)만 보고하는 것보다 치료에 더 도움이 된다는 증거도 없다.
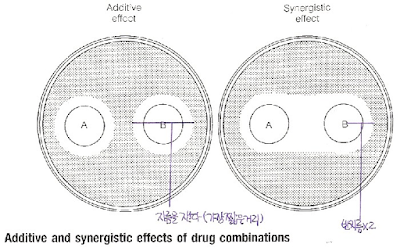
(3) 디스크 확산법 (disk diffusion method)
기초배지로 Muller-Hinton agar 배지가 흔히 사용된다. 한천의 표면에 면봉으로 시험균주의 균액을 고르게 접종하고, 그 위에 항균제 디스크를 놓는다. 배양시간 동안 디스크의 항균제는 주위의 한천으로 확산하므로, 디스크 바로 주변의 한천에는 항균제가 고농도로 분포하지만, 디스크에서 먼 곳의 한천에는 항균제가 낮은 농도로 분포한다.
이와 같은 한천의 항균제 농도경사에 의해서 세균 증식의 억제대가 형성된다. 즉, 디스크와 일정 거리에 있는 한천의 항균제 농도는 시험균주에 대한 MIC가 되며, 이 point보다 안쪽의 한천에서는 균주가 증식을 못 하지만, 이 point 밖에서는 균주가 증식한다. 디스크 확산법에서는 이 억제대의 지름을 측정해서 균주의 시험항균제에 대한 감수성 양상을 결정한다.
디스크 확산법으로는 MIC를 측정할 수 없다. 또한 증식이 느린 세균, 혐기성 세균 등의 항균제 감수성을 측정할 수 없는 단점이 있다. 그러나 이 방법은 시험이 간단하고, 비용이 적게들며, 시험항균제를 수시로 바꿀 수 있는 장점이 있다. 우리나라의 미생물 검사실 대부분은 이 방법을 이용해서 항균제 감수성 시험을 하고 있다. 최근 일본에서는 디스크 억제대의 크기가 MIC와 비례하는 점을 이용해서 디스크 확산법으로 MIC를 추정하는 방법도 개발되었다.
(4) E-test 확산법 (E-test strip method)
확산법을 이용한 항균제 감수성 시험 방법이다. 그러나 일반적인 디스크 확산법과는 달리 MIC를 측정할 수 있다. 방법도 쉽고 간편하기 때문에 통상적인 감수성 시험에 사용할 수도 있다. 그러나 Etest strip의 가격이 상당히 비싸며, 항균제당 넓은 면적의 평판배지가 필요한 단점이 있다.
(5) 미생물 자동화 기기 판정법
2) 디스크 확산법 (disk diffusion method)의 방법
Kirby-Bauer disk diffusion method를 가장 많이 사용함
 |
Kirby-Bauer antibiotic sensitivity procedure |
① 균 접종액의 준비
a. 순수 배양된 평판 배지에서 잘 분리된 집락 4-5개를 선별하여 백금이로 증균용 배지에 접종한다.
b. 37℃ 부란기에서 표준탁도액의 농도 이상으로 균이 발육될 때까지 배양한다. (약 3-5시간 배양이 적당하다.)
c. 배양액을 표준탁도액의 농도와 같도록(시험관의 규격이 동등해야 한다)멸균된 생리식염수나 액체배지로 희석한다.
② 균의 접종
a. 균 배양액의 농도를 맞춘 후 15분 이내에 멸균된 면봉을 균 배양액에 적셔서 시험관 내벽에 돌리면서 눌러 짜서 과다한 균액을 제거한다.
b. 표면이 마른 평판 한천 평판 배지 위에 균액이 적셔진 면봉을 골고루 문질러 접종한다.
c. 평판 뚜껑을 닫고 3-5분동안 방치하여 표면의 습기가 흡수되도록 한다.
③ 디스크 접종
a. 디스크 디스펜서를 이용하여 필요한 디스크를 균이 골고루 접종된 한천 평판배지에 놓고 디스크 중앙을 가볍게 눌러 한천 표면에 완전히 부착시킨다.
b. 디스크 간의 간격은 충분히 떨어져야 한다. 각 디스크 중심간의 간격은 24㎜ 이상이어야 하며 평판 가장자리로부터 15㎜ 이상 떨어져야 한다. 90㎜ 배지에는6개, 100㎜에는 8개, 150㎜에는 중앙에 3개, 가장자리에 9개의 디스크를 놓는다.
c. 디스크를 놓은 평판은 약 30분 동안 정치시킨 후 37C 부란기에 평판 뚜껑이 밑으로 가도록 놓아 배양한다.
④ 판독
a. Zone Reader나 자 등을 이용하여 발육 억제대 의 직경을 측정하여 기록한다.
b. 발육억제대 주변에 미약한 발육이나 작은 집락의 형성은 발육이 억제된 것으로 간주하고 큰 집락이 생겼을 경우는 계대 배양하여 다시 동정해서 재실험하여야 한다.
⑤ 발육 억제대 크기의 해석 (NCCLS standard)
3) 감수성 시험 결과의 오류
감수성 시험 결과의 신뢰성을 확보하기 위해서는 참조균주 (reference strain)를 사용해서 꾸준히 정도관리를 해야한다. 또한 참조 균주의 시험 결과가 오차 허용범위 내에 들었다고 해서 검사결과 모두가 정확하다고 할 수는 없다. 감수성 시험 결과가 비전형적인 경우에는 재검 혹은 균종 감별의 재확인이 필요하다.
(1) 디스크 확산법 결과 오류의 흔한 원인
① 배지의 오류
디스크 확산법에는 흔히 Muller-Hinton 한천이 사용되며, 한천의 두께가 틀리거나 배지의 성분이 잘못되면 오류가 생길 수 있다. 특히 한천의 두께는 매우 중요하므로, 반드시 4 ㎜인 것을 확인해야 한다. 한천의 두께가 4 ㎜보다 얇으면 디스크의 항균제가 더 빠르고 넓게 확산되므로 억제대의 크기가 더 커지고, 이에 따라서 내성균주를 감수성으로 판정할 우려가 있다. 반대로 한천이 두꺼우면 항균제가 느리고 좁게 확산되므로 억제대 크기가 작아지며, 따라서 감수성균주를 내성으로 판정할 우려가 있다.
② 디스크의 오류
디스크의 역가가 수송이나 보관의 잘못 혹은 오랜 보존에 의해서 변성되면 감수성 균주를 내성으로 잘못 판정할 수 있다.
③ 시험균주의 오류
시험균주가 오염되었거나, 접종 균액의 탁도가 잘못되면 감수성 시험결과의 오류를 유발할 수 있다. 오염이 있는 경우에는 억제대가 이중으로 나타나는 경우가 많다. 즉, 결과 해석시 이중의 억제대가 관찰되면 오염을 의심하고, 균종 동정부터 다시 시험하는 것이 좋다. 한편 항균제에 따라서 감수성 시험 결과가 균주의 접종량에 영향을 많이 받을 수도 있다. 접종 균액의 탁도가 너무 높으면 억제대가 좁아질 수 있으며, 반대로 탁도가 너무 낮으면 억제대가 커질 수 있다.
④ 참조균주의 오류
참조균주가 오염 혹은 변이되면 그 날 시험한 감수성 결과 모두를 믿을 수 없게 되므로 주의해야 한다.
⑤ 배양 조건의 오류
배양온도 혹은 환경에 의해서 감수성 시험결과가 영향을 받을 수 있다. 특히 CO2 농도가 높은 환경에서 배양하면 CO2에 의해서 항균제의 역가가 감소할 수 있으므로 주의해야 한다.
⑥ 검사자의 오류
억제대 측정, 기록 혹은 breakpoint의 잘못된 적용에 의해서 오류가 생길 수 있다.
(2) 오류의 종류
① Very major error1)
내성균주를 감수성으로 보고하는 것이며, 미생물 검사실에서 절대로 범해서는 안될 오류이다. 이 오류는 특정 항균제에 내성인 균주의 감염증 치료에 임상의사가 그 항균제를 사용하는 결과를 유발할 수 있으며, 이는 감염증 치료의 실패와 직결되므로 특히 주의해야 한다.
② Minor error
감수성을 중간내성으로, 중간내성을 내성으로 혹은 그 역으로 보고하는 것이다.
1) Major error : 감수성균주를 내성으로 보고하는 것이다. 이 결과는 임상의사의 항균제 선택 폭을 줄이기는 하지만, 다른 감수성 항균제를 사용하면 되므로, 감염증 치료 실패와 직결되는 오류는 아니다.
실험 기구 및 시약
1. 실험 재료
장내세균, Staphylococcus | Mueller-Hinton agar plates |
항생제 (Doxycyclin, Nalidixic acid, Oxytetracyclin, Cefoperazone, Lyncomycin) | |
항생제 디스크 | 10원짜리 동전 |
Malachite green, Crystal violet | 항온기 |
멸균된 면봉 | 알코올 램프 |
핀셋 | |
실험 방법
1. 실험 과정
1) Broth에 키운 세균을 멸균된 면봉을 이용하여 Mueller-Hinton agar plates에 접종했다.
2) 그 위에 각 항생제가 묻어있는 디스크를 올려놓았다. Malachite green과 Crystal violet이 묻은 디스크와 10원짜리 동전도 올려놓았다.
3) 37℃에서 24시간 동안 배양시켰다.
4) Inhibitor zone의 직경을 잰 뒤 항생제 표를 통해 각 세균이 각 항생제에 감수성이 있는지를 (SRI; susceptible, intermediate, resistant) 알아보았다.



!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글