실험 목적
물질마다 고유하게 갖고 있는 밀도가 서로 다르다는 사실을 이용한 실험을 통해 미지의 물질이 무엇인지 알아낼 수 있다.
실험 이론 및 원리
밀도(density)는 물질의 질량을 부피로 나눈 값(질량/부피)으로 물질마다 고유한 값을 지닌다. 일반적으로 밀도는 고체 > 액체 >> 기체순이며, 예외적으로 물은 액체 > 고체 >> 기체 순으로 밀도가 크다. 고체나 액체의 경우 밀도는 온도나 압력이 변해도 거의 변하지 않지만, 기체의 경우 분자 운동이 활발해져 밀도가 작아지고, 압력이 높아지면 밀도가 커진다.
밀도가 다르다는 것을 시각적으로 알기 위해서는 물질이 층을 이루어야 한다. 하지만 물질이 서로 섞여 구별할 수 없는 경우가 있다. 이 이유 중 하나는 일반적으로 극성은 극성끼리, 무극성은 무극성끼리 섞이는 성질이 있다는 것이다.
극성은 일반적으로 두 개 이상의 원자로 이루어진 분자의 구조적 비대칭성이나 구성 원자간의 전기 음성도 차이에 의하여 전자구름이 한 방향으로 몰려서 일어나는 것이다. 상대적으로 전기 음성도가 큰 원자는 –전하를 띠게 되고, 전기 음성도가 작은 원자는 +전하를 띄게 되는 것을 쌍극자라 한다. 이때 두 극의 세기와 두 원자핵 사이의 거리를 곱한 벡터량을 쌍극자 모멘트라 하고, 상대적으로 +전하를 띠는 것을 δ+, -전하를 띠는 것을 δ-와 같이 표현할 수 있다.
쌍극자 모멘트, 즉 원자간 작용하는 힘을 벡터로 표현하여 분자에 작용하는 총 벡터의 합이 0이라면 무극성이고, 합이 0이 되지 않는다면 극성이라 표현할 수 있다. 또한, 극성을 판단하는데 있어서 분자의 구조적 대칭성에 따라 판단할 수도 있지만, 이는 항상 적용되는 것이 아니므로 쌍극자모멘트를 따져서 극성을 판단하는 것이 좋다.
물 같은 경우에 단순히 구조상으로 대칭이기 때문에 무극성 분자라고 생각할 수도 있는데, 산소에 수소와 공유하지 않은 전자가 남아있어 전자가 고르게 분포되어 있지 않다. 따라서 물은 쌍극자모멘트의 합이 0이 되지 않으므로 극성이다.
사실 극성과 무극성은 상대적인 개념이다. 극성의 세기는 쌍극자 모멘트의 값과 비례하여 증가하는데, 물 같은 경우에는 전기음성도 차이가 크기 때문에 큰 극성을 갖고 있다. 그러나 이번 실험에서 사용하는 MC(Methylene chloride)의 경우에는 전기음성도 차이가 크지 않아 매우 약한 극성을 갖고 있다. 따라서, 극성이 강한 물의 입장에서는 극성이 매우 약한 MC는 거의 무극성에 가깝기 때문에 MC가 극성을 갖고 있다하더라도 물에 녹지 않는다.
위 사실을 바탕으로 결론을 내리자면, 극성과 무극성은 상대적으로 따져야하며 섞는 물질끼리 비슷한 정도의 극성이면 잘 섞인다는 것이다.
실험 기구 및 시약
물질 A, B, C, 매스실린더, 바이알, 유리막대, 스포이드
실험 방법
1) 미지의 물질 A,B,C를 7㎖씩 매스실린더에 담는다.
2) 각 용매의 질량을 측정하고, 밀도를 구한다.
3) 바이알에 용매 A/B, B/C, C/A, A/B/C/를 담는다.
4) 후보군으로부터 용매 A,B,C를 구한다.
후보군 : THF(Tetrahydrofuran), EA(Ethyl acetate), Hexane, MC(Methylene chloride), H2O, Toluene, Chloroform
실험 결과
과정2에서 미지의 시료 A의 질량은 9.23g, B는 6.74g, C는 4.54g이고 각각 부피는 7㎖이므로 다음과 같이 표현할 수 있다.
A밀도 = 9.23(g)/7(㎖) = 1.3186(g/㎖)
B밀도 = 6.74(g)/7(㎖) = 0.9629(g/㎖)
C밀도 = 4.54(g)/7(㎖) = 0.6486(g/㎖)
밀도는 A > B > C순으로 결과가 나왔다는 것을 확인할 수 있다.
오른쪽부터 용매 A/B, B/C, C/A이다. 사진에서 볼 수 있듯이 용매 A/B와 B/C는 층을 이루고 있지만 용매 C/A는 섞인다는 것을 알 수 있다. 즉, A와 C는 비슷한 극성을 가지고 있으며 B는 비슷하지 않은 극성을 갖고 있다는 것을 유추해낼 수 있다. 또한 용매 A/B에서 A가 밑에 있는 층이므로 무거우며 B/C에서 B가 밑에 있으므로 무겁다는 것을 알 수 있는데, 이는 위에서 구한 밀도 A>B>C 순서가 실험으로써 입증되었다는 것을 보여준다.
미지의 물질이 무엇인지 알기 위해 후보군의 특성을 알아보도록 하겠다.
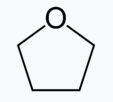
THF는 분자구조 보듯이 쌍극자 모멘트가 0이 되지 못하기 때문에 극성을 띄고, 밀도는 0.889(g/㎖)이다. | |
EA 또한 쌍극자 모멘트가 0이 아니라 극성을 띄며, 밀도는 0.902(g/㎖)이다. | |
Hexane은 그림처럼 완벽한 대칭구조를 이루고 있으며 쌍극자 모멘트가 0이므로 무극성을 띄며, 밀도는 1.33(g/㎖)이다. | |
MC는 디클로로메탄이라고도 하는데, 밀도가 1.33(g/㎖)이며 쌍극자모멘트의 합이 0이 되지 않으므로 극성을 띤다. | |
물은 밀도가 1(g/㎖)이고 실험원리에 설명했듯이 쌍극자모멘트의 합이 0이 되지 않으므로 극성이다. | |
Toluene의 벤젠에 CH3이 붙어있는 형태로, 쌍극자모멘트의 합이 0이 되므로 무극성이며 밀도는 0.867g/㎖이다. | |
Chloroform의 밀도는 1.49(g/㎖)이며 쌍극자 모멘트의 합이 0이 아니기 때문에 극성을 띤다. |
물질 | 밀도(g/㎖) | 극성 유무 |
THF | 0.889 | 극성 |
EA | 0.902 | 극성 |
Hexane | 0.655 | 무극성 |
MC | 1.33 | 극성 |
H2O | 1 | 극성 |
Toluene | 0.867 | 무극성 |
Chloroform | 1.49 | 극성 |
위에서 구했듯이 A의 밀도는 1.3186(g/㎖)이고 B의 밀도는 0.9629(g/㎖), C의 밀도는 0.6486(g/㎖)이고, A와 B는 비슷한 극성이며 B는 비슷하지 않은 극성이다.
B는 0.0371의 차이로 물과 가장 가까운 값이 나왔으므로, 극성을 띄는 물이라는 것을 알 수 있다. 그러면 A와 C는 물과 비슷하지 않은 극성, 즉 무극성이거나 극성이더라도 MC처럼 매우 약한 극성이어야 한다. A는 0.0114 차이로 MC의 밀도값과 가장 가까우며, C는 0.0064의 차이로 Hexane과 가장 가까운 값이 나왔다. MC는 물과 섞이지 않고, 무극성인 Hexane 또한 극성인 물과 섞이지 않는다. 따라서 실험값으로부터 A는 MC, B는 물, C는 Hexane이라고 결론을 낼 수 있다. 참고로 용매 C/A에서 두 물질이 섞이는 이유는, MC는 구조적으로 극성을 띤다하더라도 매우 약하기 때문에 무극성인 Hexane과 비슷한 극성이므로 섞이게 되는 것이다.
미지의 물질 | 미지의 물질 밀도 | 신뢰성 높은 후보군 | 후보군과의 오차 |
A | 1.3186(g/㎖) | MC | 0.0114 |
B | 0.9629(g/㎖) | 물 | 0.0371 |
C | 0.6486(g/㎖) | Hexane | 0.0064 |
마지막으로, 가장 무거운 물질부터 넣으면 다음과 같이 된다.
아래부터 A, B, C의 순서로 위치해있는 것을 볼 수 있다. 한편, 위 사진에서는 세 개의 층이 명확히 보이지 않고, 가장 맨 아래 층과 윗 층이 이어져 있는 모습을 볼 수 있다. 이는 마지막에 C를 넣을 때 너무 위에서 떨어뜨려 액체의 속력이 빨라져서 물질B를 뚫고 들어가 A와 연결이 된 것으로 보인다.
토의 사항
이 실험에서는 MC, 물, Hexane을 서로 비교해봤지만 같은 원리를 적용하여 Chloroform, EA(Ethyl acetate), 물을 비교해보자.
위 표에서 볼 수 있듯이 물과 Chloroform은 섞이지 않으며, 물과 EA도 섞이지 않고, Chloroform과 EA는 섞이는 것을 볼 수 있다. 물의 극성도는 9, Chloroform의 극성도는 4.1, EA의 극성도는 4.4이다. 즉, 비슷한 극성끼리는 섞인다는 것을 위 참고 자료에서 알 수 있다. 또한 Chloroform의 밀도는 1.49(g/㎖), EA의 밀도는 0.902(g/㎖), 물의 밀도는 1(g/㎖)이다. Chloroform, 물, EA 순으로 바이알에 넣는다면 본 실험처럼 세 개의 층이 생기게 될 것이라 예상할 수 있다.
우리는 일상생활에서도 이 원리를 접하고 있다. 가장 대표적인 예는 물과 기름이 섞이지 않고, 기름이 물 위에 뜬다는 것이다. 기름이 물 위에 떠있다는 것은 밀도가 가볍기 때문인 것이고 섞이지 않는다는 것은 극성인 물과 반대인 무극성을 갖고 있다는 것을 의미한다. 그리고 이를 이용하여, 술이나 우유와 같은 여러 일상 제품들의 밀도와 극성을 알아보는 실험으로 확장할 수 있다. 비록 부정확할지라도 일상생활에서 미지 물질의 밀도를 측정할 수 있다는 것이 의의가 있다고 생각한다.
본 실험은 대체로 결과값이 잘 나와서 후보군과 서로 매치를 하는데 큰 어려움이 없었지만, 그래도 오차가 생긴 원인을 간단히 짚고 넘어가보자.
1) 밀도는 압력과 온도에 따라 달라진다. 고체와 액체는 큰 영향을 받지는 않지만, 그래도 실험 중 미지의 물질을 측정하는 곳이 압력과 온도가 일정하다고 확언할 수 없기 때문에 정확한 값을 측정하지 못했을 수 있다.
2) 매스실린더를 저울 위에 놓고 영점을 맞추었었다. 그리고 미지의 물질을 넣었는데 그 과정에서 매스실린더 밖으로 잘못 떨어뜨린 적이 있었는데 이 때문에 정확한 질량을 재는 것에 실패했었다. 다음에는 매스실린더 안에 용액을 천천히 떨어뜨리는 것에 주의하는 것이 좋을 것으로 보인다.
약간의 실수는 있었지만 오차가 심하지 않아 만족할만한 결과가 나왔다고 생각한다.
한편, 만약 미지의 물질이 모두 비슷한 극성을 갖고 있을 경우, 물질끼리 층이 생기지 않아 밀도의 대소 관계를 알 수 없다는 것이 이 실험의 한계점이라고 할 수 있다. 미지의 물질을 바꿀 수 없는 상황이라면, 주변에서 쉽게 구할 수 있는 물이나 기름 등을 통해 간접적으로 접근하면 한계점을 어느 정도 극복할 수 있을 것이라 생각한다.
반면에 미지의 물질이 서로 다른 극성일 때, 모두 비슷한 밀도를 갖고 있을 경우도 생각해볼만하다. 첫 번째 가설은 밀도가 거의 비슷하다면 물질의 무게가 비슷하다는 것을 의미하므로 유리막대로 저어주면 설탕물처럼 상하 관계없이 골고루 섞일 것이라는 것이다. 두 번째 가설은 유리막대로 살살 저어준다고 해도 먼저 넣은 물질이 그 다음 넣은 물질 위로 올라갈 만큼의 무게나 속력 차이가 없으므로 변화가 없을 것이라는 것이다.
이에 대한 실험은 해보지 않아 정확한 결론을 내릴 수는 없지만, 두 가지 가설 모두 어떤 물질의 밀도가 크고 작은지 확언할 수 없는 상황이다. 밀도를 알기 위해서는 유리막대로 물질들을 살살 저으면 항상 일정한 밀도순대로 층이 생겨야한다. 그러나 첫 번째 가설의 경우 섞인 상태가 되므로 어떤 것이 무겁고 가벼운지 알 수 없으며, 두 번째 가설의 경우 무조건 어떤 물질이든 처음 넣은 물질이 가장 아래에 위치할 것이므로 미지 물질의 정확한 밀도 측정이 어렵다.
이 한계점 또한 위와 동일하게 구할 수 있는 것들을 통해 간접적으로 알아내면 어느 정도 보안할 수 있을 것이라 생각한다. 그러나 이 방법은 근본적인 한계점 극복 방안이 될 수 없으므로 이러한 점들을 보안할만한 후속실험 또는 더 정밀한 실험 방법이 요구된다.













!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글