주족 금속
주기율표에서 각 족에 있는 금속들의 성질은 비슷하다. 그들은 비슷한 산화상태를 가지고, 그 족의 모든 다른 원소의 화합물과 비슷한 화학식을 갖는 화합물을 만든다. 예를 들면 II족의 금속은 MO형의 산화물을 만든다. 주조금속들 중에는 IA족 금속의 성질이 가장 비슷하다. IA족 다음부터는 동족원소라도 그들의 화학적, 물리적 성질이 차이가 더 많이 나타난다. 즉, 화학적 성질은 알루미늄과 탈륨이 비슷한 것보다 나트륨과 세슘이 더 비슷하다.
각 주족에서 금속의 최대 산화상태는 족의 수와 같다. 실제로 많은 금속에서 0보다 큰 산화상태가 하나밖에 없을 때에는 그 산화상태는 족의 수와 같다. 그러나 IIIA, IVA, VA족의 보다 무거운 원소에서 족의 수보다 2 단위 작은 산화상태는 비활성 전자쌍의 효과로 더욱 안정하게 된다. 주기율표에서 왼쪽 아래에 있는 금속들은 가장 센 환원제이다. 따라서 세슘은 가장큰 음의 환원전위를 가지리라고 예상되지만 리튬이온의 수화엔탈피가 크기 때문에 세슘보다 리튬의 환원전위가 더 음성을 띤다. 그러나 나트륨은 주기율표에서 세슘보다 높은 위치에 있기 때문에 세슘보다 약한 환원제이고 탈륨은 세슘보다 오른쪽에 있으므로 훨씬 약한 환원제라는 것을 짐작 할 수 있다.
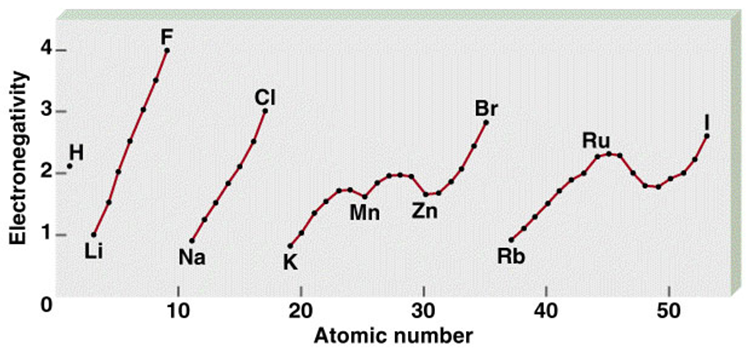 |
원자번호에 따른 전기음성도 |
둘 이상의 산화상태를 가지는 6주기 원소에서는 5주기의 동족원소에 비하여 낮은 산화상태에서 더욱 안정하다. 또한 오른쪽에 위치하는 원소일수록 낮은 산화상태가 더욱 안정해진다. 그래서 납(II)이 주석(II)이나 탈륨(I)보다 산화하기 어렵다.
주기율표에서 왼쪽에서 오른쪽, 아래에서 위로 가는데 따라 금속산화물의 염기성은 감소한다.
2 주기의 리튬, 베릴륨 및 붕소는 그들보다 족의 수가 하나 큰 3주기원소와 매우 비슷한 성질을 지닌다. 이렇게 성질이 비슷한 것은 그들의 전기음성도의 값이 가까운데 원인의 일부가 있다. 알카리 금속에서 리튬만 탄산수소염보다 탄산염의 용해도가 작으며, 이 점은 마그네슘과 무거운 알카리 토금속과 비슷하다. 리튬은 공기속의 질소와 반응하는 유일한 알카리 금속이며, 마그네슘도 비슷하게 반응한다.
6Li + N2 → 2Ni3N
3Mg + N2 → Mg3N2
알카리 금속염 중에서 리튬염은 이온형성이 가장 적고 마그네슘화합물과 같은 정도의 공유결합성을 지닌다. 예를 들면 염화리튬의 녹는점은 다른 알카리 금속의 녹는점의 경향보다는 오히려 염화마그네슘의 녹는점에 접근한다. 또 리튬은 마그네슘과 비슷하게 과산화물과 초과산화물이 아닌 보통의 산화물을 만든다. d들은 단순한탄화물을 만들고 그 인산염은 물에 녹지 않는다. Li+와 Mg2+ 는 모두 세게 수화를 한다. 이들의 염화물은 유기용매에 녹는다.
베릴륨은 할로겐과 같은 전기음성도가 큰 원소와도 비교적 공유결합성이 큰 화합물을 만든다. 알루미늄도 그 염화물은 녹는점이 비교적 낮으며, 베릴륨과 비슷한 경향을 나타낸다. 그러나 BeCl2 나 AlCl3에서의 결합은 약간 이온성이다.
환원력이 세고 그 산화물은 물과 반응하여 센 염기를 만들며, 그 이온은 가수분해하지 않는 금속을 염기성이라고 한다. 주족 금속의 염기성은 주기율표에서 왼쪽에서 오른쪽으로 갈수록 감소한다. 같은 족 안에서는 가벼운 원소에서 무거운 원소로 갈수록 염기성이 증가한다.
1. 알카리 금속
리튬, 나트륨, 칼륨, 루비듐, 세슘 및 프란슘을 알카리금속이라 하고 그 전자배치는 비활성기체의 전자배치에 1개의 전자를 더 첨가한 구조이다. 이 금속들은 어느 다른 원소보다 이온화 에너지가 낮고 주로 이온성 화합물을 만든다. 이들은 모두 열전도도와 전기전도도가 크며 무르고 녹는점이 낮은 금속으로서 서로가 합금을 만들 뿐만 아니라 실온에서 액체인 수은과도 합금을 만든다. 이 합금들은 고체금속 대신에 환원제로 자주 사용된다. 알카리 금속은 -33℃에서 액체 암모니아에 녹아서 푸른 용액으로 된다. 이 용액은 전기를 전도하며, 이 때 전극에서 화학반응은 일어나지 않는다. 이 용액은 알카리 금속 이온과 용매화된 전자를 함유한다고 알려졌다.
Na → Na+ + e- (용매화된)
저온에서 암모니아를 증발시키면 알카리금속으로 회수할 수 있다. 그러나 용액에 열을 가하면 금속아미드화물로 된다.
2Na + 2NH3 → 2NaNH2 + H2
알카리금속은 전기음성도가 가장 낮고 염기성이 가장 센 원소이다. 그들은 양의 산화상태로만 존재하며, 그들의 환원전위에 나타난 것처럼 가장 센 환원제이다.
2. 알카리토금속
IIA족금속들은 주로 녹주석(Be3Al2S6O18), 돌로마이트(CaCoO3ㆍMgCO3) 카르날라이트(MgCl2ㆍKClㆍ6H2O), 스트린트아네이트(SrCO3) 및 중정석(BaSo4) 속에 포함되어 있다. 또한 그들의 이온은 바닷물에 비교적 많이 포함되어 있다.
알카리금속과 같이 무거운 알카리토금속은 액체 암모니아에 녹아 짙은 푸른색 용액으로 된다. 칼슘의 경우 암모니아를 증발시키면 칼슘의 산화상태가 0인 화합물을 생성한다.
Ca (s) → Ca2+ + 2e- (용매화된) → Ca(NH3)6
알카리토금속은 알카리금속보다 염기성이 약하다. 염기성은 원자번호가 증가함에 따라 증가하고 무거운 원소의 환원전위는 나트륨의 환원전위와 비슷하다.
탄산칼슘, 탄산 lac 탄산수소이온 사이의 평형으로부터 종유석과 석순이 있는 석회굴이 생기는 흥미 있는 현상을 볼 수 있다. 석회굴은 오랜 세월에 걸쳐서 이산화탄소들을 포함한 지하수에 석회석이 녹아서 생긴 것이다.
CaCo3 (s) + H2O + CO2(aq) ⇋ Ca2+(aq) + 2HCO3-(aq)
3. IIIA족 금속
IIA족의 첫 번째 원소인 붕소는 비금속이지만 다른 원소들은 금속이다. 알루미늄과 갈륨은 산화상태가 +3 인 화합물을 만든다. 인듐과 탈륨은 +3의 산화상태 외에도 +1의 산화상태의 화합물을 만든다. IIIA족금속들은 IA, IIA족금속들 보다 염기성이 약하다. +3의 산화상태에선ㄴ 공유결합서이 센 화합물을 생성한다. 알루미늄의 표준환원준위는 -1.66V로 맹 활성이고 실온에서 Al2O3로 쉽게 산화된다. 그러나 Al2O3는 금속표면에 단단한 피막을 형성하므로 그이상의 산화는 일어나지 않는다. 그러므로 알루미늄은 식기, 건축재료 등으로 널리 쓰인다.
IIA족의 다른 금속들은 Al보다 용도가 적다.
4. IVA족 금속
IVA족의 금속으로는 게르마늄, 주석 과 납이다. 게르마늄은 반도체에 쓰이고 다이아몬드형의 결정을 만들기 때문에 이들 중에서 금속성이 약하다. 모든 금속은 산화물을 코우크스로 환원하여 얻는다. 게르마늄과 주석은 자연에서 산화물로 산출되지만 주요한 납광석은 방연광(PbS)이다. 방연광을 공기 속에서 구워 산화물로 만든 다음 그 산화물을 환원한다.
2PbS + 3O2 → 2PbO + 2SO2
PbO +C → Pb + CO
이들 원소의 가장 바깥전자배열은 ns2np2이며, 이들의 최고산화상태는 +4이다. 그러나 어떤것도 +4 또는 -4이온을 형성하지 낳는다. 탄소와 비슷하게 금속원자는 4개의 공유결합을 형성한다. 또한 비활성쌍의 효과로 이 금속들의 최고산화상태보다 2단위 적은 산화상태를 나타낸다. 주석(II)와 게르마늄(II)는 좋은 환원제이지만 납(II)은 그렇지 않다.
IVA족 금속들은 모두가 휘발성인 공유결합성인 사 할로겐화물을 만든다. 이들 할로겐화물 중에서 안정하다고 볼 수 없는 PbI4 와 PbBr4를 제외하고는 모든 할로겐화물이 만들어 졌다. 사 할로겐화물들은 모두 루이스산이고 쉽게 가수 분해 된다.
GeCl4 + 2H2O → GeO2 + 4HCl
게르마늄은 트렌지스터와 태양전지를 만드는데 쓰인다. 주석은 철판에 입혀서 부식을 방지하고, 합금은 녹는점이 낮은 땜납으로 쓰인다. 금속납과 납유리는 핵 방사선을 차단하는데 쓰인다. 안티몬과 구리를 함유하는 납의 합금은 침식에 견디므로 화학공장의 파이프나 해저전선을 피복하는데 쓰인다. 납과 안티몬의 합금은 납축전지를 만드는데 대량으로 쓰인다. 납페인트는 유독한데 요즈음에는 독성이 없고 색변화가 거의 없는 이산화티탄을 많이 사용하게 되었다.
5. VA족 원소
VA족원소인 안티몬과 비스무트는 자연계에 드물게 존재한다. 그들은 납, 구리, 주석과 함께 주로 황화물광물에 함유되어 있다. 금속은 광물을 구워서 산화물로 바꾼 다음 탄소로 환원하여 얻는다.
2Sb2S3 + 9O2 → 2Sb2O3 + 6SO2
Sb2O3 + 3C → 2Sb + 3CO
안티몬은 주로 납, 주석, 철 및 구리와 합금을 만드는데 사용된다. 비스무트의 합금은 녹는점이 낮고 Wood합금 (50% Bi, 25% Pb, 12.5% Sn, 12.5% Cd)은 71℃에서 녹는다. 비스무트와 그 합금은 대부분 고체로 될 때 팽창하므로 활자를 만드는데 적합하다.
이 원소들은 +5, +3의 산화상태를 나타낸다. 안티몬과 비스무트의 삼 할로겐화물은 피라밋형 분자구조를 가진 화합물이다.

!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글