효소활성 조절
1. Allosteric 효소(allosteric enzyme)
Allosteric이란 "입체구조상 다르다"는 뜻이며 allosteric 효과란 효소의 기질결합부위와는 입체적으로 다른 부위(allosteric site)에 저분자 화합물(ligand)이 비공유결합적으로 결합하여 효소활성을 변화시키는 현상을 말한다. 이러한 기능을 가진 효소를 allosteric 효소(allosteric enzyme) 또는 다른자리 입체성 효소라 한다.
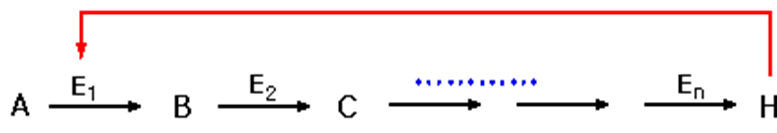 |
| Fig. 1 Allosteric 효소에 의한 되먹임 효과 |
지금 어떤 물질 A가 중간체 B, C, … 를 거쳐서 H로 되는 생합성 경로를 생각하면 각 반응은 E1, E2, …, En의 효소에 의해 촉매되는 것으로 가정한다(Fig. 1). 이 때 최종생성물 H가 Fig. 11에 점선으로 나타낸 것처럼 효소 E1을 저해하여 그의 생성량을 조정하는 형식의 되먹임 저해(feedback inhibition) 또는 최종생성물 저해(end product inhibition)라는 현상이 있다. 이 경우 H는 효소단백질 E1의 활성부위와는 다른 부위(조절부위)에 결합하여 E1의 입체배위를 변화시켜 활성을 저하시키는 것을 많이 볼 수 있으며 효소 E1이 allosteric 효소이기 때문에 이와 같은 현상이 일어난다.(Fig. 2 참조)
한편 효소와 결합하여 이와 같은 allosteric 효과를 나타내는 물질을 effector라 한다. Allosteric 효소의 종류는 많으며 그 효과도 다양하여 기질, 기타의 대사물질이 effector로서 결합하여 allosteric 효소의 반응을 저해 또는 촉진한다. Hemoglobin이나 acetylcholine 수용체도 효소는 아니지만 allosteric 효과를 나타내는 단백질이다. 각 subunit에 effector와 기질이 결합하여 서로 영향을 미치는 현상을 협동성(cooperativity)이라 한다. 단일 기질이 협동적으로 결합하는 경우를 양의 homotropic interaction이라 하고 기질과 다른 effector가 결합하여 기질결합 부위의 친화성이 증가하는 경우를 양의 heterotropic interaction이라 한다. 협동성은 같은 효소라도 pH, 이온강도, 공존하는 이온의 종류, 온도 등에 의해서 변화한다.
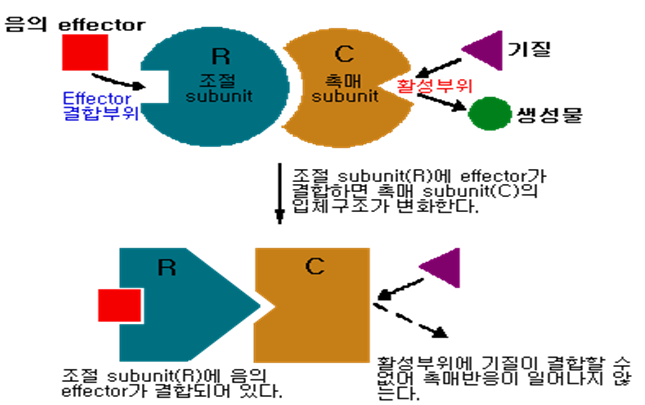 |
| Fig. 2 Allosteric 효소에 대한 음의 effector의 작용기구 |
Effector가 존재할 때 allosteric 효소의 반응속도 V와 기질농도 [S]의 관계를 Fig. 3에 나타내었다. ⒜는 effector가 존재하지 않는 경우이고 ⒝는 촉진효과가 있는 effector(양의 effector)가 존재하는 경우이며 ⒞는 저해효과가 있는 effector(음의 effector)가 존재하는 경우이다. allosteric 효소는 일반적인 효소처럼 쌍곡선을 나타내는 것이 아니라 subunit들의 협동성에 의해 S자형(sigmoid) 곡선을 나타내며 effector에 의해 Km이 변화한다.
 |
Fig. 3 Allosteric 효소의 기질 포화 곡선 |
예를 들면 aspartate transcarbamoylase의 일반적인 기질포화곡선은 Fig. 3의 ⒜에 나타낸 것처럼 S자형 곡선으로 양의 협동성을 나타내며 homotropic한 allosteric 효과를 나타낸다. 지금 이 효소에 양의 allosteric effector인 ATP를 첨가하면 효소는 활성화된 곡선 ⒝를 나타내며 Michaelis-Menten식에서 나타나는 곡선에 가까워진다(allosteric 활성화). 한편 음의 effector인 CTP(cytidine-5'- triphosphate)가 첨가되면 효소활성이 저해되어 S자형 곡선의 정도가 커진 곡선 ⒞를 나타낸다(allosteric 저해).
효소나 단백질이 allosteric 효과를 발현하여 기질 포화곡선이 sigmoid형으로 되는 기구는 협동적인 현상을 중심으로 subunit의 구조변화와 그 사이의 협동적 상호작용에 의하여 설명하는 이론으로서 MWC(Monod-Wyman- Changeux) 협동대칭성 모델(concerned, all or none, two-state symmetry model)과 KNF(Koshland- Nemethy-Filmer) 연속모델(sequential model)이 있다.
2. 가역적 공유결합에 의한 효소활성의 변화
생체내에는 효소 단백질의 아미노산 잔기를 특이적으로 수식하는 효소가 존재하며 이들에 의하여 효소가 가역적으로 수식되면 활성의 변화가 일어난다. 이와같은 방법은 대부분 단계적 폭포(cascade)기구를 통하여 대사조절에 관여한다.
Cascade 기구는 외계의 미약한 정보가 세포내의 제 2 messenger에 전달되고 그 정보가 증폭되어 처리되는 것에 의해 생체반응을 조절하는 것이다. 예를 들면 glycogen 분해에 의한 혈당조절기구에서 epinephrine이나 glucagon이 막에 존재하는 수용체에 작용하면 adenylate cyclase가 활성화되고 이어서 protein kinase가 활성화되며 이것이 glycogen phosphorylase kinase를 인산화로 수식하여 활성화하면 glycogen을 분해하여 glucose-1-phosphate를 생성하는 cascade적 증폭반응을 일으킨다.(Fig. 4 참조)
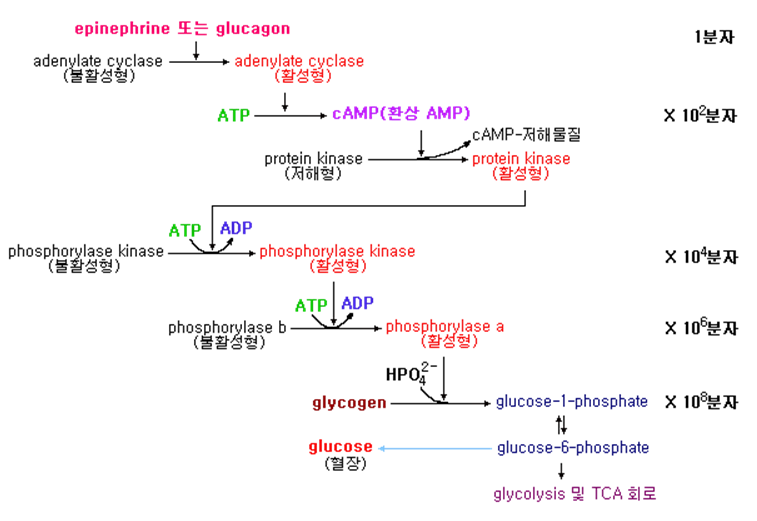 |
Fig. 4 Glycogen 분해에서 cascade적 증폭기구 |
신경자극에 의한 glycogen 분해에서는 Ca2+가 제 2 messenger로 되어 glycogen phosphorylase를 직접 활성화 한다. Allosteric 효과와 비교하여 cascade적 증폭에 의한 효소활성 발현은 한층 높고 cascade의 수가 증가함에 따라서 그 증폭력은 대수적으로 증가한다.


!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글