Barium titanate
BaTiO3(Barium titanate)는 온도에 따라서 고체결정의 구조가 달라지며, 밝혀진 것 만 5가지로, 체심입방구조(bcc)를 비롯한 조밀육방격자구조(hcp), 정방정(tetragonal), 사방정(orthorhombic) 그리고 삼방정(rhombohedral) 구조를 가진다. 하지만 일반적으로는 BaTiO3는 Perovskite 구조의 예로 쓰이곤 하는데, 러시아의 광물학자 페로브스카이트의 이름을 따서 지은 결정구조명이라 한다.
그림 1 바륨티타네이트의 결정 구조 | |
조금 복잡해보이긴 하지만 사실은 bcc구조이다. Ba2+ 와 TiO4의 티타늄이 bcc의 중앙에 위치한 구조이며, 산소 원자들은 바륨이 이루는 격자의 면 중앙에 놓이게 된다.
평상시에 보통의 1개의 입자 내부에서는 분역이 90도 또는 180도의 방향을 향하고 있다. 여기에 큰 전계를 가하면, 각각의 방향을 향하고 있던 분역은 모두 한쪽방향을 향하게 된다. 그러나 강유전체는 이러한 전계가 없이도 분극하고 있으며, 항전장 이상의 전계를 가함에 의해 분극 방향이 정렬되어 분극이 커진다.
그림2는 이러한 강유전성을 비롯하여, 그 외의 유전특성인 전장(E)-분극(P) 곡선을 나타낸다. 이와 같은 상태에서 전계를 작게 하여도 분극량이 크게 감소하지 않는다. 전계의 방향은 항전계에 도달할 때까지 변하지 않고, 항전계를 넘어서면 분극방향이 반전되게 되는데 이러한 물질을 강유전체라 한다.
 |
| 그림 2 여러 가지 유전현상 |
BaTiO3는 강유전성을 띠는 산화물로 알려져 있다. 온도가 1460℃ 이하일 때에는 육방정 구조를 취하다가 1460℃이상일 때에는 perovskite 구조로 상전이가 발생하게 된다.
 |
| 그림 3 BaTiO3의 격자상수[From H.F kay and P.vousdan, Phil. Mag., 7,40,1019(1949).] |
perovskite 구조 내에서 BaTiO3 는 여러 가지 다른 동질 이상을 갖는다. 온도 120℃이상에서는 상 유전 특성을 나타내는 입방정 구조가 안정하지만, 120℃ 아래로 온도가 떨어지면서 정방정 구조를 띠게 된다. 정방정 구조를 띠게 되면서 강유전성을 나타내게 된다.
이렇게 120℃를 기준으로 상유전성에서 강유전성으로 성질이 바뀌는데 이러한 온도를 Curie 온도(Tc)라고 한다. 전기적 특성을 갖는 BaTiO3의 유전율은 상온에서 일반적으로 2000-3000사이의 값을 갖게 되고, BaTiO3결정립의 크기 혹은 불순물 등에 의해서 영향을 받는다. 페로브스카이트형 강유전체는 화학적으로 안정되고 두 개의 금속 이온을 다른 이온으로 치환하는 고용체 형성의 가능성이 있기 때문에 화학적 양론에 대하여 많은 연구가 진행되고 있다.
상전이 온도는 물질에 의해 1000℃부터 저온까지 분포하고 있으며 유전율 ε는 Tc에 피크를 나타내지만 큐리 점 전후에서도 일반적인 재료보다도 높은 값을 갖는다. 이러한 강유전체는 저온 영역에서 자발분극이 발생하고 압전성을 나타내는 공통의 특징이 있기 때문에 고체 콘덴서, 초전형 적외선 센서, 초음파 발생 검출기, 압전 점화기 등 여러 가지 방면에 실용화가 되고 있다. 1957년 Bailey는 CaTiO3의 상전이에 대해서 연구를 하였으며 1969년 Wyckoff는 페로브스카이트 산화물의 격자 변위와 큐리 온도에 대해서 고찰하였다.
1993년 Liebermann CaTiO3의 온도특성에 대해서 전기적 특성의 고찰보다도 TEM 및 SEM을 이용하여 구조적 특성만을 연구하였다. BaTiO3커패시터의 전기적 특성에 관한 연구는 Ba 및 Ti 부분을 치환하여 입자의 크기를 변화시키거나 첨가제를 고용시킴으로서 고유전율의 유전체 및 온도보상용등 목적에 맞도록 크게 두 가지로 나눌 수 있다. 고유전율의 특성을 갖는 커패시터는 가유전 분역과 입계에 의해서 유전율이 높은 전기적인 특성을 나타나지만 전압 및 온도에 따른 유전율의 변화가 심하게 된다.
Barium titanate의 이성질체
1. 오르토티탄산바륨
화학식 Ba2TiO4, 암적색 분말이다. 냉각시킨 묽은 황산용액에는 염화바륨과 티탄산화물 졸이 되어 용해한다. 탄산바륨과 산화티탄(IV)를 혼합한 후 하소하여 얻는다. 하소 온도는 혼합비율에 따라 다르지만, 보통 1,100~1,300℃이다.
2. 메타티탄산바륨
화학식 Ba2TiO3, 결정형이 다른 5종의 염이 알려져 있다. 4종은 페로브스카이트형구조이고, 나머지 1종은 육방정계이다. 페로브스카이트형의 것은 염화바륨․탄산바륨 및 산화티탄을 혼합한 후 하소하여, 이것을 물과 질산으로 처리한다. 육방정계의 것은 탄산바륨과 산화티탄을 혼합한 후 하소하여 얻는다. 이러한 티탄산바륨은 고유전율, PTC(Positive Temperature Coefficient)반도체성, 강유전성, 압전성 등의 특성을 가지고 있다.
즉, 상온에서는 유전상수가 1500정도이며 입방정과 정방정사이의 큐리온도 부근에서는 6000~1만 정도이고 순수한 티탄산바륨은 높은 비저항값(p=1010Ω㎝)을 갖는 절연체이지만 La, Pr, Na, Gd, Nb, Sb, Ta원소를 미량(0.1cation%) 첨가하여 Ba과 Ti의 원자위치에 각각 치환될 경우, 실온에서 1010~104Ω㎝의 비저항 값을 나타내어 반도성 전기적 전도특성을 갖는다. 또한 강유전재료 특유의 전압-전하관계가 히스테리시스 곡선을 나타내고 힘을 가하면 전압이 발생하고 역으로 전압을 가하면 변위가 발생하는 압전성을 나타내는 최초의 압전 세라믹스로 보고되고 있다.
Barium titanate 생산방법
BaTiO3 분말의 제조방법은 현재 가장 널리 쓰이고 있는 고상법과 액상법으로 크게 나눌 수 있다. 이 중에서 고상법은 하소시켜 제조하는 방법으로 제조된 BT(BaTiO)는 유전재료 및 압전재료로 사용되며 불순물의 혼입이 쉽고 입자가 크고 불균일 하여 유전상수가 낮다는 단점이 있으나 제조 방법이 간다하여 가장 널리 사용되고 있다.
1. 고상반응법
여러 가지의 조성으로 된 세라믹스 분말을 제조할 때 일반적으로는 각 조성 원소를 포함하는 산화물과 탄산염 등의 분말을 배합, 혼합한 후 고온에서 반응시키는 방법이 이용되고 있다.
BaCO3 + TiO2 → BaTiO3 + CO2 ·····(1)
(x)NiO + xZnO + Fe2O3 → NixZnxFe2O4 ·····(2)
SiO2 + 3C → SiC + 2CO ·····(3)
3SiO2 + 6C + 4N2 → 2Si3N4 + 6CO ·····(4)
Ti + NH3 → TiN + 3/2H2 ·····(5)
(1)은 전형적인 티탄산 바륨의 합성으로 900~1300℃에서 반응시킨다. (2)는 페라이트 합성으로서 산소 분압에 주의할 필요가 잇다. (3), (4), (5)는 일부 기상도 관여하는 반응의 예이다.
실제의 제품을 만들 때의 공정은 다음과 같다.실제의 제품을 만들 때의 공정은 다음과 같다.
원료분체(AO) | | 원료분체(BO2) | ||
| | | | |
칭 량 | | 칭 량 | ||
| | | | |
| | 혼 합 | | |
| | | | |
| | ↓ | | |
| | 가 성 | | |
| | ↓ | | |
| | 분 쇄 | | |
| | ↓ | | |
| 소결체 제조용 분체 | | ||
| | ↓ | | |
| | 성 형 | | |
| | ↓ | | |
| | 소 결 | | |
| | ↓ | | |
| 제 품(ABO3) | | ||
원료분말 AO 및 BO2를 각각 칭량하고 볼밀 등을 사용하여 잘 혼합을 한 후 가소한다. 가소에서는 원료염의 열분해 및 원료간에 고상반응 등의 이른바 화학적 변화가 일어나고 화학적으로 균일한 화합물 및 고용체 등의 생성물을 얻는다. 그러나 동시에 입자의 형태변화 및 뒤에 설명할 입자간의 결합이 생기고 원료는 정도의 차는 있지만 약간 소결한 상태로 된다. 분쇄 공정에서는 가소에서 얻은 생성물을 분쇄하여 소결체 제조용의 분말로 하고 이것은 더욱 더 성형 및 소결의 공정을 거쳐 최종제품으로 된다.
고상반응에 의한 분말의 제조에서 가소는 분체의 거의 모든 성질을 결정하므로 소결의 용이성 및 소결제품의 품질을 결정하는 가장 중요한 공정이다. 그러나 가소에서는 입자에 화학적 및 물리적으로 많은 변화가 일어나고 그들에 영향을 미치는 인자의 수도 많으므로 기술적으로도 과학적으로도 아주 복잡하다. 일반적으로 가소에는 최적조건이 존재하고 물질의 종류에 의해 변화하는 것은 물론 원료의 상태, 로의 종류, 가열조건, 분위기 및 다른 여러 가지 조건에 의해 두드러진 영향을 받는다.
 |
| 그림 4 |
가소 중에 일어나는 변화중에서 가장 중요한 것은 화학변화와 분체의 미구조 변화이다. 위의 모델을 사용하여 소성조건이 이들 변화 및 생성분체의 성질에 미치는 영향을 살펴보면, 고상반응은 AO입자와 BO2입자와의 접촉점을 중심으로 일어나고 입자표면에 생성물층이 만들어지고 그 두께는 반응시간과 함께 증가한다. 이 사이에 원료입자 및 생성입자의 사이에 소결도 일어나고 입자의 결합이 생긴다. 생성물층의 두께와 입자의 결합은 시간과 함께 증가하고 한쪽만을 선택적으로 일으키는 것은 곤란하다.
그림 (b)는 낮은 온도에서 단시간의 가소 후 입자의 상태를 표시하였다. 입자 간의 결합은 약하고 분쇄에 의해 용이하게 개개의 입자로 되지만 반응은 완결하여 있지 않고 중심부에는 미반응의 물질이 남아있다. 그림 (d)는 고온 장시간의 가소의 경우로 반응은 완결하여 있지만 입자끼리의 소결이 뚜렷하다. 입성장 및 입자의 형태변화도 일어나고 있다. 생성물은 딱딱한 괴로 되어있어 분쇄하여도 소결성이 부족한 분체로 될 수밖에 없다.
1) 고상반응법의 특징
① 무게, 부피가 줄어든다.
② 가루가 된다.
③ 반응이 한정된 장소(양자의 접촉점)에서 밖에 일어나지 않는다.
④ 미반응의 원료 자체는 출발상태의 순수물이며 열역학적으로 말하면 활량은 1이다.
⑤ 반응의 진행중에는 반응물이 생성물의 층을 통하여 상대방까지 이동하여야만 하는데 고상내의 물질이동은 일반적으로 곤란하고 따라서 반응은 물질이동 속도에 의해 율속이 된다.
2. 단일 침전법
원료를 용융상태로 혼합하여 용액속에 적당한 침전제를 첨가시켜 세라믹 분체를 얻는 방법으로서 그 원리는 용액 속 이온들의 용해도적을 이용한 방법이다. 일반적으로 분말은 1㎛이상이 되면 침전되고 보통은 1차 입자들의 응집체인 2차 입자인 경우가 많다.
3. 공침법
용액의 조성을 목적하는 세라믹스 분말 조성에 맞추어 용액중의 모든 이온을 동시에 침전시켜 침전분말을 만드는 방법이다. 침전물은 일반적으로 수산화물, 탄산염, 수산염 등의 형태로 얻어지며 침전 PH차이가 커서 단일 침전물의 혼합물의 상태로 되는 경우가 많다
4. 화합물 침전법
화합물 침전법은 원자 단위의 성분의 균일화를 이룬 방법이라 할 수 있다. 즉, 용액 속의 금속 이온 조성을 세라믹스 원료의 금속 조성과 동일하게 하여 그 조성을 그대로 화합물로서 침전시키는 방법이다. 이 방법으로는 조성의 균일성이 뛰어난 원료분말을 합성할 수 있으나 하소 단계에서는 조성이 불균일해 질수 있다는 단점이 있다.
5. Sol-gel법
sol-gel 법에 의한 세라믹 분말 제조법은 생성된 분말의 우수한 기계적 물성과 높은 화학적 순도 때문에 점차 그 응용 영역이 확대되고 있는 추세이다. 이는 metal oxide들의 가수 분해 및 축합 반응을 통하여 얻어진 젤을 열처리하여 유기 성분을 제거하고 metal oxide를 얻는 방법이다. sol-gel법은 젤화 하는 양태에 의해 크게 두 가지로 나누어진다.
첫번째로 콜로이드 법은 용액 내의 콜로이드 입자의 분산에 의해 원료 용액인 졸을 형성하고 그 후에 졸 상태의 불안정화에 의해 젤화 되는 방법이다. 두 번째 방법은 출발 물질로써 알콕사이드와 같은 금속 유기화합물을 사용하여 졸을 만들고 이를 가수 분해 및 고분자 농축 반응을 거쳐 젤 상태로 만들게 된다.
강유전체 세라믹스를 제조할 때 특히 sol-gel법을 이용하여 BaTiO3 분말을 제조할 경우 일반적으로 금속 알콕사이드(alkoxide)를 출발 원료로 사용한다. 알록사이드를 사용한 sol-gel법으로 BaTiO3 분말을 제조한 경우 물이 첨가되면 다음의 식(6)및 (7)와 같은 가수 분해 반응이 진행된다.
Ti(OR)4 + 4H2O -- Ti(OH)4 + 4ROH·····(6)
Ba(OR)2 + 2H2O -- Ba(OH)2 + 2ROH·····(7)
여기서 R=CnH2n+이다. 이는 결국 반응의 생성물로 수산화물이 석출하고 알코올이 추출된다는 의미이다. 이러한 결과는 앞서 소개한 공침법에 의한 분말 제조 방식과 매우 유사하게 보일 수 있으나 근본적으로 sol-gel 법에서는 가수 분해에 의하여 중합체가 형성된다는 점이 중요한 차이점이다. 즉 가수 분해 반응이 중합 반응에 비하여 지나치게 빠르지 않다면 가수 분해에 의하여 석출이 일어나기 보다는 중합 반응에 의하여 고분자가 형성되며 이러한 Ba-Ti고분자는 주위의 알코올 등의 액상을 포획함으로써 젤화 된다.
졸로부터의 성공적인 젤화는 가수 분해 반응과 중합 반응의 속도차가 크지 않은 경우이며 이를 위하여 산이나 염기를 첨가하여 반응속도를 조절하기도 한다. 식(7)의 반응에 쓰인 바륨 알콕사이드(Ba(OR)2)는 일반적으로 공기중의 수분과 급격히 반응하므로 우리가 원하는 (Ba, Ti)중합체를 얻기 어렵다. 따라서 바륨 알콕사이드 대신에 수산화 바륨(Ba(OH)2·8H2O)을 원료로 사용하는 경우가 많다. Ti-알콕사이드와 수산화 바륨을 1:1몰 비로 혼합할 경우 다음과 같은 반응이 진행될 것으로 사료된다.
Ti(OR)4를 가수분해 시키면 알킬기(R)가 떨어져 나가면서 Ba-O-Ti-(OH)2를 기본 골격으로 한 고분자가 형성된다. 알콕사이드의 고분자화에 영향을 미치는 인자로는 물과 알콕사이드의 혼합비, 반응염의 희석 정도, 온도, 전해질의 유무 등이 있다. 한편, 고분자들이 형성되면 고분자들의 ostwald ripening이 일어나는데 이 과정을 통하여 작은 고분자는 용해-석출 과정을 통해 큰 고분자로 성장하게 되어 고분자화가 가속된다. 이렇게 고분자 단위가 성장하고 연결되어 연속적인 network을 형성하고 액상을 포함하게 되는데 이를 젤화라 한다.
결국 젤화 되는 동안 성장하는 고분자들끼리 서로 접합하고 엉키기도 하고 교차하면서 점도가 급격히 증가하게 된다. 이렇게 생성된 젤을 건조 및 열처리함으로써 BaTiO3 분말을 얻을 수 있다. 낮은 온도에서 건조하면 유기 성분들이 분해, 휘발 되며 약 300-500℃에서 수산기가 분해된다. 약 600℃가 되면 거의 대부분이 휘발 되고 결정질의 BaTiO3가 나타나기 시작한다. 알콕사이드를 이용한 sol-gel법은 입도가 작고 화학적 균일도가 크다는 장점이 있는 반면 값이 비싼 점이 단점으로 지적되고 있다.
6. 습식직접합성법
염화물 및 수화물을 출발원료로하여 pH 및 온도를 적절히 조정하여 줌으로서 목적물의 침전을 얻는 방법이다. 이 방법으로서는 결정성이 뛰어난 산화물 형태의 침전물을 직접 얻을 수 있을뿐 아니라 pH 및 온도제어를 통하여 크기가 제어된 형의 입자, 조성이 균일한 초미립자등을 얻을 수있다.
7. 수열합성법
가수분해 반응을 100℃이상에서 시키면 100℃이하에서는 생성되지 않는 화합물을 얻을 수 있다. 밀페된 용기(autoclave)내에서 100℃이상의 고온 고압하에서 물의 존재하에 물질 사이의 반응을 일으켜 새로운 물질을 만드는 방법을 수열합성법이라 한다. 이 방법은 다성분계 산화물을 합성하는데 매우 유용하며 원하는 분말을 비교적 낮은 온도에서 용액으로부터 직접 얻을 수 있기 때문에 하소 과정 등이 필요하지 않다는 큰 장점이 있다. 또한 가격이 저렴한 원료를 사용할수 있고, 입자크기, 입자모양 등을 비교적 쉽게 제어할 수 있다는 장점도 있다.
8. 기상합성법
기상합성법은 증발-응축법, 기항화학 반응법, 기상산화법, 기상분해법 등으로 분류할 수 있으며 기상합성법에 의하여 생성되는 원료 분말의 특징은 다음과 같다.
① 입경의 분포가 좁고 입경이 1㎛이하의 초미분체를 쉽게 얻을 수 있다.
② 기상에서의 물질농도가 낮아 생성입자의 응집이 적다.
③ 분위기 제어가 용이하여 산화물 이외에 질화물, 탄화물 등의 비산화물 미립자 를 얻을 수 있다.
④ 고순도 생성물을 쉽게 얻을 수 있다.
a. 증발-응축법
증발-응축법은 원료를 전기저항 가열, 고주파 가열, 아크 가열, 프라즈마 가열등으로 기화시켜, 아크나 프라즈마의 온도 구베를 이용하여 급냉시켜 미립자를 얻는 방법이다. 이 방법으로 얻어지는 분말의 입도는 100-1000Å의 미립이며, 단일 산화물, 복합 산화물, 탄화물 및 금속 미분체 합성 등에 많이 쓰인다.
b. 기상반응법
기상반응법은 단일화학 물질을 열 분해 시키거나 2종이상의 화합물가닁 반응을 시켜 분말을 합성하는 방법으로 전자의 경우에는 목적으로 하는 원소를 모두 함유하고 있는 적당한 화합물이 있어야 하는 것이 필수적이며, 후자의 경우에는 여러화학물질의 조합이 가능하므로 좀더 융통성이 있다. 기상반응법의 출발원료로는 제조가 용이하며 반응성도 비교적 높은 금속염화물이 많이 사용되며, 이 방법에 의한 미립자 제조에는 생성물의 성질이 반응계의 물리 화학적 특성 이외에도 반응기의 구조, 가열방법, 반응가스의 도입방법 등에 크게 의존한다.
Barium titanate의 용도, 성질 및 특성
티탄산바륨은 고유전율, PTC(Positive Temperature Coefficient)반도체성, 강유전성, 압전성 등의 특성을 가지고 있다. 즉, 상온에서는 유전상수가 1500정도이며 입방정과 정방정사이의 큐리온도 부근에서는 6000~1만 정도이고 순수한 티탄산바륨은 높은 비저항값(p=1010Ω㎝)을 갖는 절연체이지만 La,Pr,Na,Gd,Nb,Sb,Ta원소를 미량(0.1cation%) 첨가하여 Ba과 Ti의 원자위치에 각각 치환될 경우, 실온에서 1010~104Ω㎝의 비저항값을 나타내어 반도성 전기적 전도특성을 갖는다. 또한 강유전재료 특유의 전압-전하관계가 히스테리시스 곡선을 나타내고 힘을 가하면 전압이 발생하고 역으로 전압을 가하면 변위가 발생하는 압전성을 나타내는 최초의 압전 세라믹스로 보고 되었다.
그림 5 Barium titanate의 유전성에의해 사용되는 축전지와 음향변환소자 | |
압전 현상을 이용하여 마이크로·픽업 등의 전기음향 변환소자나 점화장치로, 유전율이 높은 것을 이용하여 라디오·텔레비전 등의 소형 대용량의 자기축전지로 쓰인다. 또, 분극히스테리시스효과가 직사각형에 가까운 특성을 보이는 데서 증폭기, 전자계산기의 기억소자, 변조기 등으로 사용된다. 그밖에도 티탄산바륨 및 그 고용체에 세륨·니오브·탄탈 등을 가한 것은 반도체로도 사용되며, 전자공업 분야에서 용도가 증가하고 있다.
강유전성 재료는 유전율이 온도, 주파수 및 직류 바이어스 전압 등에 따라 변화가 크고, 유전손실도 큰 단점이 있지만, 전자제품이 소형경량화 추세와 고주파 회로의 체택 등에서 유리하기 때문에 많이 사용되게 되었고, 앞으로의 실생활에 더 많은 기여가 기대된다.
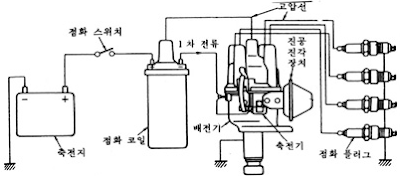 |
| 그림 6 접점식 점화장치 구성 |

.PNG)




!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글