Barium titanate에서의 Ba/Ti비의 변화
BaTiO3 세라믹에서 Ba/Ti비는 미세구조에 크게 영향을 미치는 것으로 많이 알려져 있으며, 또한 이런 미세구조의 변화는 BaTiO3 의 전기적 특성에 직접영향을 주기 때문에 Ba/Ti비에 따른 소결거동의 변화와 입자성장에 대해 관찰하는 것은 매우 중요한 일이다. BaTiO3 세라믹에서 과잉 TiO2 인 경우 소결이 촉진되는 것으로 알려져 있으나 그 원인에 대해서는 아직 명확한 설명이 없는 실정이다.
Mostaghaci등은 과잉 TiO2가 불순물로 존재하는 SiO2, Al2O3등과 반응하여 공융액상 형성온도인 1320℃보다 훨씬 낮은 1240℃에서 액상을 형성할 수 있으므로 과잉 TiO2 가 증가할수록 치밀화가 촉진되었을 가능성이 있다고 주장하였다. 또한 1329℃에서 형성되는 액상으로 인하여 소결이 촉진된다는 의견도 나오고 있으나 1320℃이하에서도 치밀화가 촉진되므로 타당성있는 설명이 되지 못한다.
BaTiO3 세라믹에서 비정상 입자성장은 쉽게 관찰되지만 그 원인또한 정확하게 밝혀져 있지 않다. 비정상 입자 성장의 원인에 대해 Ti-rich액상이 반드시 존재하는 조건에서 용해-재석출의 과정에 의하여 일어난다는 보고가 있는 반면, 최근에는 공융온도 이하의 온도에서도 고체확산에 의하여 비정상 입자성장이 일어나는 것으로 관찰되었다.
이러한 비정상 입자성장 대부분이 Twin과정에 의하여 시작된다는 주장이 일고있는데, 즉 (111)Twinning plane에서 re-entrant angle이 형성되므로 twin이 일어나지 않은 입자보다 Planar nucleation의 확률이 높기 때문에이 방향으로 입자가 빨리 성장하여 비정상적인 성장을 보인다는 이론이다. 이러한 주장의 이론은 공융온도 이하에서 장시간 소결시 plate-like형상으로 성장한 큰 입자에는 항상 (111)twin이 존재하고 있기 때문이지만, 이러한 (111)twin은 비정상적으로 성장한 큰 입자에만 존재하는 것이 아니면 정상입자성장이 일어난 작은 입자에서도 관찰되므로 이 이론또한 타당하지 않다.
1. Ba:Ti의 비에 따른 BaTiO3의 여러 가지 특성
성형체 | 중량(㎎) | 1220㎎ | |
직경×두께(㎜) | 12㎜×3.98㎜ | ||
밀도(g/㎤) | 2.710g/㎤ | ||
소결체 | 중량(㎎) | 1187㎎ | |
직경×두께(㎜) | 9.804㎜×3.372㎜ | ||
수축률(%) | 18.30% | ||
밀도(g/㎤) | 4.663g/㎤ | ||
성형후의 밀도(g/㎤) | 1.953g/㎤ | ||
C(pF) | 정전용량 | 90.8pF | |
tanσ | 유전손실 | 0.0214 | |
R(㏀) | 저항 | 0Ω | |
εr | 유전상수 | 458.2865 | |
Qf | Q-factor | 46.729 | |
Ba:Ti=0.99:1인 BaTiO3
성형체 | 중량(㎎) | 1208㎎ | |
직경×두께(㎜) | 12㎜×4.21㎜ | ||
밀도(g/㎤) | 2.537g/㎤ | ||
소결체 | 중량(㎎) | 1181㎎ | |
직경×두께(㎜) | 9.659㎜×3.362㎜ | ||
수축률(%) | 19.50% | ||
밀도(g/㎤) | 4.796g/㎤ | ||
성형후의 밀도(g/㎤) | 2.259g/㎤ | ||
C(pF) | 정전용량 | 90.31pF | |
tanσ | 유전손실 | 0.0245 | |
R(㏀) | 저항 | 0Ω | |
εr | 유전상수 | 467.9302 | |
Qf | Q-factor | 40.816 | |
Ba:Ti=1.01:1인 BaTiO3
Barium titanate에서의 Ba/Ti비에 따른 소결거동의 변화
 |
| 그림 7 1400℃에서 시간변화에 따른 수축곡선 |
그림 7은 온도와 1400℃에서의 시간 변화에 따른 수축곡선을 나타내며 Ba/Ti비의 변화에 따라 소결거동이 변하고 있음을 잘 보여주고 있다. 과잉 TiO2의 양이 2㏖%까지 증가할수록 (Ba/Ti비 감소) 소결 시작온도가 내려가고 소결이 더욱 촉진되며 2㏖%이상까지 첨가하면 더 이상의 소결촉진은 일어나지 않음을 알 수 있다.
BaTiO3는 과잉 TiO2와 반응하여 1320℃부근에서 공융액상(eutetic melt)을 형성하는 것으로 잘 알려져 있다. 따라서 과잉 TiO2의 조성인 경우 1320℃이상에서 소결할 경우 액상형상으로 인하여 치밀화가 증진된다는 많은 보고가 있다. 그러나 그림 1에서 보듯이 액상형상에 의하여 치밀화가 중진된 것이 아님을 알 수 있다. 과잉 TiO2의 조성의 시편의 경우 공융액상 형성온도 이하인 1300℃에서 이미 소결이 완료되었으며, 과잉 TiO2가 없는 시편의 경우 1400℃에서도 소결이 계속 진행되고 있음을 알 수 있다.
이 결과는 과잉 TiO2에 의한 소결촉진 현상은 액상소결에 의하여 촉진되는 것이 아님을 보여준다. 오히려 액상이 존재하는 1320℃이상에서 소결할 경우 액상에 의한 입자 성장 촉진으로 입내에 많은 기공들이 포획되어 더 이상의 치밀화는 어려운 것으로 관찰되었다. 과잉 TiO2에 의한 소결촉진 현상에 대해, 과잉 TiO2가 불순물로 존재하는 SiO2, Al2O3등과 반응하여 1240℃부근에서 액상을 형성하기 때문이라는 주장이 나오고 있으나, 불순물을 분석해본 결과 SiO2는 40ppm이하로 검출되었으므로 소결촉진 현상을 불순물에 의한 액상현상 때문이라고는 설명할 수 없다.
또한 TiO2가 BaTiO3 에 고용이 될 경우 다음의 식과같이.
TiO2 = TiTi +20O +VBa + VO
Ba vacancy와 O vacancy를 형성하므로 diffusivity가 증가하여 소결이 촉진되었다고도 볼 수 있으나 보고서에 따르면 TiO2는 0.1㏖%의 극미량만 BaTiO3 에 고용이 되는 것으로 알려져있다. 따라서 과잉 TiO2영역은 모두 고용한계를 벗어나므로 과잉 TiO2가 증가할수록 소결이 촉진된다는 현상은 defect model로도 설명이 되지 않는다.
그림 8 | 그림 9 X-peak |
그림 8는 하소된 분말의 morphology를 SEM으로 관찰한 이미지로, 그림 2에서 보듯이 과잉의 TiO2가 증가할수록 하소된 분말의크기가 감소됨을 알 수 있다. 즉 고상반응 과정에서 BaTiO3자체 분말보다 큰 ㏖ar volume을 갖는 이차상이 형성될 경우 입자간에 stress가 유발되어 작은 입자로 쉽게 분쇄될 가능성이 있다.
그림 9은 1200℃에서 2hr 하소후 측정한 x-ray peak를 보여준다. BaTiO3계에서 이차상에 대한 연구이론은 많이 보고되고 있으나 아직 정확한 반응기구는 밝혀지지 않고있다. 일반적으로 잘 알려진 이차상으로는 BaTiO4, BaTiO5, BaTiO7 등등이 있으나 이번 실험에서 발견된 x-ray peak들은 이러한 이차상이 아닌 것으로 확인되었으며, 소결후에도 존재하는 매우 안정한 상임을 알 수 있었다.
그림 9에서 나타내는 상은 모두 이차상이며 불행히도 아직까지 어떤 상인지 확인이 되지 않고 있지만 Ba/Ti비에 따라 이차상의 조성 및 상대적 양이 달라짐을 알 수 있다. 따라서 과잉 TiO2가 증가할수록 소결이 촉진되는 현상은 하소분말의 크기가 감소하여 activity가 증가한것도 한 원인이 됨을 알 수 있었다. 앞에 자료로부터 BaTiO3 세라믹에서 Ba/Ti비의 변화에 따라 다음과 같은 소결 거동의 변화가 나타났음을 알 수 있었다.
즉, BaTiO3계에서 과잉 TiO2양이 2㏖%까지 증가할수록 소결의 시작온도는 낮아지며, 치밀함은 증진됨을 알 수 있다. 그러나 2㏖%이상의 첨가는 치밀화를 더 이상 증진시키지 못한다. 이러한 과잉 TiO2에 의한 치밀화의 증진은 액상소결에 의한 것이 아닌, 하소된 분말의 크기가 감소한 것이 하나의 원인임을 알 수 있다.
Barium titanate의 전기적 성질에 영향을 미치는 불순물
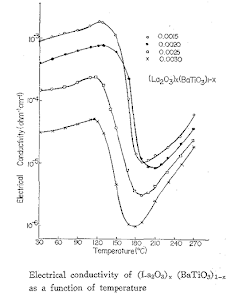
아래의 결과에서처럼 0.0015㏖%의 란탄계 산화물을 첨가하였을 때 전기전도도는 가장 높은 값을 나타내며 첨가제가 증가함에 따라 전기전도도는 낮아진다. La2O3에서는 첨가제량의 차이에 따라 전기전도도 값에 차이가 많았으나 Nd2O3와 Dy2O3로 변함에 따라 그 변화폭이 줄어들었다.
Nd2O3 | Dy2O3 |
첨가제가 증가함에 따라 grain들이 서로 다른 방향으로 접촉하고 있을 때 Fermi level이 평행되므로 grain boundary에서 space charge가 생긴다. 따라서 space charge는 donor 첨가 이온으로부터 전도 전자를 위한 potential barrier를 형성하게 되며 이 potential barrier가 커지면서 전기전도도는 작아진다.
결론적으로 첨가제가 La2O3로부터 Nd2O3, Dy2O3로 원자번호가 증가함에 따라 전기전도도는 4f 궤도의 전자 중첩효과로 증가된다. 첨가제가 0.0015㏖%일 때 전기전도도가 가장 높으며 첨가제가 증가함에 따라 space change layer로 인하여 감소되며 첨가제의 원자번호가 증가함에 따라 이온반경이 감소되어 전기전도도의 감소폭이 줄어들게 된다.
2. Si3N4
Si3N4 첨가량이 0.1에서 0.25wt%로 증가함에 따라 상온 비저항이 급격하게 감소하지만 0.5wt%를 넘어서면 다시 증가하게 된다. 이는 Si3N4를 첨가하지 않은 경우에는 불규칙한 입성장이 일어나서 첨가하지 않은 경우에 비해서 높은 상온 비저항을 나타내기 때문이다. 그러나 Si3N4를 첨가하게 되면 첨가량에 따라 생성되는 액상량의 차이에 의해 서로 다른 미세조직 형태를 나타내게 되어 상온비저항이 영향을 미치게 된다.
3. Sb2O3
소성온도 변화에 따른 반도체화 및 PTCR특성을 나타내는 Sb2O3 첨가량 범위는 약 0.05~0.125㏖%이며 소성온도는 1300℃이상이다. 이는 이러한 조건에서 입성장한 거대입자와 미세입자가 혼재한 복합조직을 형성하기 때문이다.
4. Y
Y+3이온은 Ba+2이온을 치환하고 이것이 lattice-distorting defects을 유발한다. Y+3이온이 증가하면서 처음에는 유전율이 증가하다다 감소하지만, 전기전도도는 9.15 ㏖%에서 최대값을 갖는다. 이는 BaTiO3에서 Y2Ti2O7 로의 상분리가 일어나기 때문이다.
5. MnO2
MnO2를 첨가하면 그 양에 상관없이 절연체로 변하게 되며 NTCR특성을 나타내는데, 이는 Mn이온 첨가에 따른 단위부피 면적당 입자 계면의 면적차이로 설명할 수 있다. 소성온도를 증가시키면 MnO2 첨가량이 증가함에 따라 상온 비저항이 증가하며 0.01, 0.02wt%일 때에 한해서 PTCR 특성을 나타낸다. 0.03wt%일 때는 소성온도에 상관없이 NTCR특성을 나타내며 이는 Mn이온 첨가에 따르는 전자보상 효과 때문이다.
6. Nb2O5
0.3㏖%Nb 까지는 격자내에 고용됨에 따라서 밀도가 증가하고 상온저항이 감소하였으나 0.4㏖%Nb이상 첨가하면 grain의 성장을 억제시키며 상온저항의 증가와 PTCR특성의 효과가 감소된다.
Barium titanate의 불순물 혼입방지를 위한 연구
정확한 물성연구뿐 아니라 불순물의 혼입을 방지하기 위한 단결정의 제작 및 실제적 응용을 위하여 양질의 큰 단결정을 육성하려는 시도가 많이 이루어지고 있다. 그중 Top-Seeded Solution Growth(TSSG) technique은 잔류 strain이 없으며 크기가 큰 단결정을 얻을 수 있다고 보고되었는데, 이는 백금 이중관의 Seed Holder를 이용하여 결정에 온도구배를 부여하고, 성장이 지속될 때 용액을 서냉시킴으로써 티타산바륨 단결정을 육성하는 방법이다.
Temperature Gradient technique은 High temperature Solution Growth technique중 하나인데, 종자결정과 solid nutrient를 동시에 밀폐된 공간에 넣고 적당한 온도구배를 가하여 nutrient로부터 종자결정으로의 물질이동이 일어나도록 하여, 적당한 방향으로 배향된 종자결정을 냉각장치가 부가된 백금 holder에 연결하고 포화된 용액표면과 접촉시켜 온도구배를 부여하면 종자결정으로 물질이동이 유발되어 결정이 성장하게 된다. 이러한 방법은 TSSG technique이라 한다.
2. Glycine-Nitrate process
이 방법은 1967년에 제안된 amorphous citrate 공정의 변형으로서, Glycine-Nitrate공정법은 금속질산염과 글리신을 물에 용해·가열하여 과량의 물을 증발시키면 자연발화가 일어나 매우 빠르게 연소되고 중간물질의 생성없이 최종 산화물을 구성하는 물질을 만드는 공정이다. 일반적으로 금속 질산염은 공기중에서 수화를 일으켜 원하는 조성을 유지하기 힘든 단점이 있기 때문에, 출발 물질을 금속 질화물이 아닌 카보네이트와 알콕사이드를 이용하고, 산화제로 질산을 도입함으로서 티타산바륨을 합성하는 공정법이 연구되고 있다.
Barium titanate 국내 생산 시장
Barium titanate소재 외에도 각종 세라믹섬유부터 산업용벨트, 기계부품, 접착코팅제, 산업용세라믹등 도매하는 회사이다.
2. 리스켐상사(Leeschem International Co., Ltd.)
Barium titanate의 분말소재를 생산하는 회사이며, 그 외에도 단결정기판,진공재료,리튬이온건전지 유무기 재료, 연료감응형 태양전지연료, 유/무기안료, 첨가제, 염로 및 중간체, 기능성특수 안료/염료 등을 생산 수출하는 회사이다.
3. 삼성정밀화학(SAMSUNG)
SFC BTP (Barium Titanate Powder)외에도 클로린/셀룰로스 계열 및 암모니아 계열의 제품을 생산하고 있다.
위에 회사 이외에도 국내 여러 회사가 다양한 재료로 Barium titanate를 생산하고, 있으며 수출까지 하고있다.

.PNG)












!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글