실험 결과
1) 보정치의 계산
0.1M HCl 용액 20㎖에 메틸레드를 소량 넣은 후 0.1M 표준 NaOH 용액으로 적정하여 보정치를 구해보자.
0.1M NaOH 적정량(㎖) | 1 회 | 2 회 | 3 회 | 평 균 |
19.7 | 19.8 | 19.8 | 19.77 |
보정치 = 19.77/20 = 0.9885
각각의 온도에 대해 시간의 따른 0.1M NaOH 용액의 적정량 및 보정량을 도표로 나타내어 보자.
보정량 = 적정량 × (1/0.9885)
시 간 (min) | 40 ℃ | 50 ℃ | 60 ℃ | |||
적정량(㎖) | 보정량(㎖) | 적정량(㎖) | 보정량(㎖) | 적정량(㎖) | 보정량(㎖) | |
5 | 9.5 | 9.61 | 12.9 | 13.05 | 13.5 | 13.66 |
11 | 14.5 | 14.67 | 14.8 | 14.97 | 15.6 | 15.78 |
17 | 16.4 | 16.59 | 16.9 | 17.10 | 17.4 | 17.61 |
23 | 17.0 | 17.20 | 17.3 | 17.50 | 17.5 | 17.71 |
29 | 17.4 | 17.61 | 17.7 | 17.91 | 17.5 | 17.71 |
35 | 17.8 | 18.01 | 17.9 | 18.11 | 17.6 | 17.81 |
41 | 17.9 | 18.11 | 17.9 | 18.11 | 17.7 | 17.91 |
47 | 18.0 | 18.20 | 17.9 | 18.11 | 17.6 | 17.81 |
53 | 18.0 | 18.20 | 18.0 | 18.20 | 17.5 | 17.71 |
60 | 18.1 | 18.31 | 17.9 | 18.11 | 17.6 | 17.81 |
※ 40℃에서는 41~47분 사이에 50℃에서는 29~35분 사이에 그리고 60℃에서는 17~23분 사이에 평형에 도달 한 것으로 추정 할 수 있다.
2. 반응차수 및 속도상수
다음과 같은 방법으로 Ct(염화 t-부틸의 농도) 및 logCt , 1/Ct 를 구하여 보자. 그리고 logCt vs t 및 1/Ct vs t 의 그래프를 그려보고 그로 미루어 보아 이 가 수 분해 반응이 1차반응인지 2차반응인지를 판단해 보자. 또한 반응온도에서의 속도상수도 구해보자.
1) C0 (초기 염화 t-부틸의 농도)
① 용액의 부피 = 125㎖ + 125㎖ + 2.5㎖ = 252.5㎖
② 염화 t-부틸의 밀도 = 0.851 g/㎖
③ 염화 t-부틸의 분자량 = 92.57 g/㏖
C0 = 2.5㎖/0.2525l × 0.851g/1㎖ × 1㏖/92.57g = 9.102×10-2M
2) Ct (일정시간 후의 염화 t-부틸의 농도)
NaOH 용액으로 적정 하였을 때 그 안의 염화 t-부틸의 농도 Ct는 다음 식에 의해서 구할 수 있다.
M1V1 = M2V2
여기서 M2(NaOH의 농도)와 V2(적정량)를 알고 있으며 V1은 20㎖이 므로 M1을 구할 수가 있다. 우리가 구하고자 하는 염화 t-부틸의 농도 Ct는 초 기의 염화 t-부틸의 농도 C0에서 M1의 값을 뺀 값이다. (∵ M1은 생성된 HCl의 농도이므로)
즉, 다음과 같이 식으로 나타낼 수 있다.
M1 × 20㎖ = 0.1M × V적정
Ct = C0 - M1
ex) NaOH 적정량이 15㎖ 이라면 그 때의 Ct의 값은 다음과 같다.
M1 = 0.1M×15㎖/20㎖ = 0.075M
Ct = 0.09102M - 0.075M = 0.01602M
※ 주의 : Ct는 농도를 나타내고 있으므로 음의 값이 나올 수가 없다. 그런데 실험을 한 결과 음의 값이 나온 경우도 있으나 실험 오차라고 생각하 고 그냥 넘어 가기로 하였다.
3) Ct & log Ct & 1/Ct
앞의 식에 의해 계산한 data들을 도표로 정리해보자.
① 40 ℃
실 험 | 시 간(분) | Ct(M)×102 | log Ct | 1/Ct |
1 | 0 | 9.102 | -1.041 | 10.987 |
2 | 5 | 4.297 | -1.367 | 23.272 |
3 | 11 | 1.767 | -1.753 | 56.593 |
4 | 17 | 0.805 | -2.094 | 124.224 |
5 | 23 | 0.502 | -2.299 | 199.203 |
6 | 29 | 0.297 | -2.527 | 336.700 |
7 | 35 | 0.097 | -3.013 | 1030.927 |
8 | 41 | 0.047 | -3.328 | 2127.659 |
9 | 47 | 0.002 | -4.699 | 50000.00 |
10 | 53 | 0.002 | -4.699 | 50000.00 |
11 | 60 | - | - | - |
※ 60분일 때의 Ct의 값이 음수로 나와서 생략하여 버렸다.
② 50 ℃
실 험 | 시 간(분) | Ct(M)×102 | log Ct | 1/Ct |
1 | 0 | 9.102 | -1.041 | 10.987 |
2 | 5 | 2.577 | -1.589 | 38.805 |
3 | 11 | 1.617 | -1.791 | 61.843 |
4 | 17 | 0.552 | -2.258 | 181.159 |
5 | 23 | 0.352 | -2.453 | 284.091 |
6 | 29 | 0.147 | -2.833 | 680.272 |
7 | 35 | 0.047 | -3.328 | 2127.659 |
8 | 41 | 0.047 | -3.328 | 2127.659 |
9 | 47 | 0.047 | -3.328 | 2127.659 |
10 | 53 | 0.002 | -4..699 | 50000.00 |
11 | 60 | 0.047 | -3.328 | 2127.659 |
③ 60℃
실 험 | 시 간(분) | Ct(M)×102 | log Ct | 1/Ct |
1 | 0 | 9.102 | -1.041 | 10.987 |
2 | 5 | 2.227 | -1.652 | 44.903 |
3 | 11 | 1.212 | -1.916 | 82.508 |
4 | 17 | 0.297 | -2.527 | 336.700 |
5 | 23 | 0.247 | -2.607 | 404.858 |
6 | 29 | 0.247 | -2.607 | 404.858 |
7 | 35 | 0.197 | -2.706 | 507.614 |
8 | 41 | 0.147 | -2.833 | 680.272 |
9 | 47 | 0.197 | -2.706 | 507.614 |
10 | 53 | 0.247 | -2.607 | 404.858 |
11 | 60 | 0.197 | -2.706 | 507.614 |
4) Graph
※ 주의 : Graph를 그릴 때 평형에 도달한 이 후의 data들은 생략하여야 한다.
5) 반응차수 및 속도상수
graph를 보면 time vs 1/Ct의 graph는 곡선(비선형적)인 반면 time vs log Ct의 graph는 직선(선형적)임을 알 수 있다. 즉, 염화 t-부틸의 가수분 해 반응은 1차 반응임을 알 수 있다. 이 반응은 1차반응이므로 다음 식에 의해서 속도상수를 구할 수 있다.
logC0 – logCt = kt/2.303
즉, time vs logCt의 graph에서 –k/2.303 가 직선의 기울기가 된다. 그러므 로 속도상수 k를 구할 수 있다. (※ logC0 는 y절편이다.)
① 40 ℃ 일 때 : k = -0.0538 min-1 × -2.303 = 0.1239 min-1
② 50 ℃ 일 때 : k = -0.0584 min-1 × -2.303 = 0.1367 min-1
3. 반응속도의 변화 및 활성화 에너지
1) 반응온도에 따른 반응속도의 변화 측정
반응속도 r = k Ct [M/min] 이므로 앞에서 구한 k값을 이용하여 반응속도 r을 구해보자.
시간 (min) | r = kCt [M/min] | ||
40 ℃ | 50 ℃ | 60 ℃ | |
5 | 0.00532 | 0.00347 | 0.00423 |
11 | 0.00219 | 0.00217 | 0.00230 |
17 | 0.00100 | 0.00074 | 0.00056 |
23 | 0.00062 | 0.00047 | 0.00047 |
29 | 0.00037 | 0.00020 | 0.00047 |
35 | 0.00012 | 0.00006 | 0.00037 |
41 | 0.00006 | 0.00006 | 0.00028 |
47 | 0.00002 | 0.00006 | 0.00037 |
53 | 0.00002 | 0.00001 | 0.00047 |
60 | - | 0.00006 | 0.00037 |
동일한 온도에서 반응속도는 시간이 경과할수록 속도가 점점 느려지는 것 을 알 수 있다. 이론적으로 초기에는 반응물의 양이 많아 속도가 빠르지만 반응이 진행될수록 그 양이 감소함에 따라 반응속도도 당연히 늦어진다.
2) 활성화 에너지
활성화에너지를 구하기 위해서 Arrehenius equation을 쓰는데 식은 다음과 같다.
k = Ae-E/RT
A : frequency factor, R : 8.314 J/㏖․K, T : 절대온도
양변에 log를 취하면,
lnk = lnA –E/RT
즉, lnk와 1/T의 그래프를 그리면 기울기가 -E/R가 되어 활성화 에너지를 구할 수 있다.
lnk와 1/T & Graph
T(K) | 1/T(K-1) | k | lnk |
313K | 0.00319 | 0.1239 | -2.0883 |
323K | 0.00310 | 0.1367 | -1.9898 |
333K | 0.00300 | 0.1900 | -1.7147 |
위의 그래프에서 기울기가 -2004.13 이다. 즉 -E/R = -2004.13 이다. 따라서 활성화 에너지 E = 16.662 KJ/㏖ 이다.
4. 평형 상수(실험치)
평형상수의 값은 다음의 평형상수식으로부터 구할 수 있다.
(CH3)3CCl + H2O → (CH3)3COH + H+ + Cl- 에서
이고[(CH3)3COH] = [H+] = [Cl-] = C0 – Ct
[(CH3)3CCl] = Ct 이므로
평형상수 k를 다시 나타내면 다음과 같다.
1) 40 ℃ 일 때 : C0 = 0.09102 M , Ct = 0.047 M
2) 50 ℃ 일 때 : C0 = 0.09102 M , Ct = 0.00047 M
3) 60 ℃ 일 때 : C0 = 0.09102 M , Ct = 0.00247 M
5. 평형상수(이론치)
먼저 k298 를 구한다.
G : Gibbs free energy, μ : Chemical potential
이므로
☞ 평형일 때
| (1) |
(CH3)3CCl + H2O → (CH3)3COH + H+ + Cl-
| (CH3)CCl | H2O | CH3COH | HCl |
ΔGo298.15(KJ/㏖) | - 64.1 | -237.1 | -177.7 | -95.3 |
ΔG° = -177.7 – 95.3 + 64.1 +273.1 = 28.2 kJ/㏖
(1) 식을 이용하여 k를 구해 보면
28200 J/㏖ = - 8.314 J/㏖·K × 298K × lnk298
∴ k298 = 1.1398 × 10-5
최종적으로 다음 식에 의해 평형상수를 구한다.
(CH3)3CCl + H2O → (CH3)3COH + H+ + Cl-
| (CH3)CCl | H2O | CH3COH | HCl |
ΔHo298.15(KJ/㏖) | -211.2 | -285.8 | -359.2 | -92.3 |
ΔH° = -359.2 – 92.3 + 285.8 + 211.2 = 45.5kJ/㏖
온도(T) | 313 K | 323 K | 333 K |
평형상수 K | 2.7615×10-5 | 4.7426×10-5 | 7.8611×10-5 |
토의 사항
1. 오차의 원인
평형상수 값이 이론치와 실험치가 큰 차이로 나타났다. 거기에 대한 오차 원인 및 다른 오차 원인을 생각해 보자.
㉠ 지시약의 변색 범위가 넓기 때문에 적정량의 정확성이 떨어졌다고 볼 수 있 다. 그러므로 인해서 보정량의 값이 조금은 잘 못 나왔을 수도 있다.
㉡ 이온화 반응에서 평형상수 계산은 농도 대신 활동도를 사용해야 한다. 하지 만 희박 용액이 아닌데도 불구하고 활동도 계수를 모두 1로 두고 농도와 활 동도가 같다고 가정하여 계산하였다.
㉢ 실험은 액체에서 행해지는데 참고문헌 데이터는 기체 상태에서의 데이터로 나타나 있다. 상이 다르면 Gibbs energy나 Enthalpy는 차이가 많이 날 것이 므로 여기서 실험치와 문헌치간의 오차가 생길 것이다.
㉣ 적정하는 과정에서 부피의 측정 및 색깔의 변화 그리고 시간의 오차 등도 이번 실험의 오차가 될 수 있다.
㉤ 염화 t-부틸의 끓는점이 50.7℃인데 50℃에서 실험을 한다면, 반응이 진행됨 으로써 농도가 감소하는 것과 증발하여 농도가 감소하는 것이 동시에 나타날 수 있다. 즉 농도가 더 빨리 감소된다.
2. 결론
본 실험을 통하여 할로겐화 알킬인 염화 t-부틸의 가수분해 반응에 대하 여 알 수 있게 되었다. 염화 t-부틸의 가수분해 반응은 적분법을 이용하여 1차 반응임을 알았다. 약간의 오차가 있긴 했지만 대체적으로 반응 속도는 온도가 증가할수록 빨라지고, 같은 온도에서는 시간이 지날수록 느려졌다. 반응믈의 농 도는 속도에는 관여하지만, 반응 차수를 변화시킬수는 없다는 것을 알았다. 또한 할로겐화 알킬 가수반응의 반응 메카니즘도 SN1 반응을 함도 관찰할 수 있었 다.
3. 실험 과제
1) 염화 t-부틸의 가수분해반응은 몇 차반응인가?
실험결과에서 Time vs ln Ct 가 선형관계를 나타내었다. 따라서 이 반응은 1차 반응이다.
2) 반응차수는 어느 반응물에 의존하는가를 어떻게 나타내겠는가?
A + B → 생성물
반응속도 r= kCαACβB
여기서 B의 농도를 고정시키고, A의 농도를 바꾸어 가면서 반응속도를 측정해 본다. 또 A의 농도를 고정시키고 B의 농도를 바꾸어 가면서 반응 속도를 측정해 봄으로써 반응물의 속도 의존도를 알 수 있다. 다른 방법으로는 B를 충분히 넣고 A의 농도에 따른 반응 속도를 관찰함으로써 알 수 있다. 본 실험에서 물은 반응 속도에 영향을 미치지 않으므로 염화 t-부틸이 반응 속도에 영향을 미친다. 또한 1차 반응이므로 염화 t-부틸의 농도가 증가하면 반 응 속도도 증가할 것이다.
3) 반응물의 농도를 달리하면 이 가수분해반응의 반응차수가 변하 겠는가?
반응속도는 변하지만 반응차수는 변하지 않는다. 다른 조건이 모두 같다면 특 정한 반응의 진행속도는 주로 반응물의 농도에 의존한다. 충돌이론에 의하면, 반응물의 농도를 증가시키면 같은 부피안에 들어있는 분자나 이온의 수가 많아 지므로 그들간의 충돌 횟수가 많아져 반응속도가 빨라진다. 그러나 이 모든 데 이터는 1차 반응을 만족한다. 따라서 반응물의 농도가 달라진다면 속도는 변화 시킬 수 있으나 차수는 변화시킬 수는 없다.
4) 이 반응의 반응메카니즘을 제시하여라.
SN1 반응. 여기서 ‘1’은 두 반응물 중에서 단지 ‘하나’만이 RDS(속도 결정 단계)에 관 여한다는 것을 뜻한다. 즉 반응속도는 기질의 농도에는 비례하지만 nucleophile 의 농도와는 관계가 없다.
① First step(1단계)
첫단계의 반응속도는 느리다. 탄소와 leaving group사이의 결합은 기질이 분해됨으로써 깨어진다.
C-L 결합의 전자가 leaving group으로 가고 carbocation이 형성된다.
즉, 3차 할로겐화알킬이 깨어져 한쌍의 이온이 생성되는 과정이다. 할로겐화 이 온과 카르보 양이온으로 되는데, 카르보 양이온은 그 속의 탄소가 양전하를 갖는 하나의 이온이다. SN1반응은 이런 이온화 과정을 거치므로 이런 반응들은 용매화에 의하여 이온을 안전화할 수 있는 H2O와 같은 극성 용매를 사용하면 크게 도움이 된다.
② Second Step(2단계)
nucleophile이 중성분자, 즉 물이나 알콜일 때는 nucleophile의 산소가 양성자 를 잃어버림으로서, 세 번째 단계에서 마지막 생성물이 형성된다. nucleophile 이 중성분자, 즉 물이나 알콜일 때는 nucleophile의 산소가 양성자를 잃는다.
반응에서, 카르보 양이온이 친핵체(H2O)와 결합하여 최초 생성물인 양성자가 첨가된 알코올을 생산하는 단계이다.
③ Third Step(3단계)
세 번째 단계에서 마지막 생성물이 형성된다. 입체장애 때문에 염화 t-부틸과 다른 3차 할로겐화 알킬들은 SN1반응을 하게 된다. SN1반응은 일종의 이온성 반응이며 용매분자, RX분자와 생성된 다른 중간체들 사이의 상호 작 용으로 메카니즘이 대단히 복잡하다. 3차 할로겐화 일킬의 SN1반응은 단계 적 반응이다.
반응에서, 양성자가 첨가된 알콜은 용매와의 빠른 가역적인 산-염기반응에서 H+을 얻는다.
제 1단계 이온화는 높은 활성화 에너지를 가지며, 전체 과정중에서 느리게 진행되는 단계이다. 3차 할로겐화 알킬의 C-X시그마 결합을 깨뜨리고 카르보 양이온과 할로겐화 이온이 생성되기 위해서는 충분한 에너지가 공급되어야 한다. 이 반응에서 카르보 양이온은 중간체이며 생성된 후에 반응이 진행되어 생성물이 된다. 중간체는 전이상태가 아니다. 중간체는 정해진 수명을 가지나, 전이상태는 그렇지 않다. 전이상태의 위치 에너지는 가장 높은 점이나, 중간 체는 일시적인 반응 생성물이고 양쪽 전이상태보다 낮은 위치에너지를 가지 나 최종생성물보다는 높은 에너지를 갖는다.
5) 시료채취량이 반응속도 측정에 미치는 영향에 대해서 설명하여라.
이 실험은 1차 반응이므로 반응 속도식을 다시 한 번 써보면 다음과 같다.
r = kCA = kCA0(1-X) = k0e-E/RTC0(1-X)
여기서 시료채취량은 초기 농도 C0와 같다고 할 수 있다. 따라서 시료 채취량 은 반응 속도와 비례하여 채취량이 많아지면 초기 농도가 높아져 반응속도가 빨 라지고, 채취량이 적으면 초기 농도가 낮아져 반응속도가 느려진다. 그러나 반응 속도는 온도, 활성화에너지, 초기농도, 전환율 등에 따라 복합적으로 작용하므로 시료 채취량만으로 속도에 미치는 영향을 나타내기에는 무리가 많고, 또한 시료 채취량은 반응속도에는 영향을 미칠지라도 반응 차수에는 관계가 없다.
참고 문헌
1. 분석 화학, 김강진 외 3명 역, 자유아카데미, p.330
2. 화학 반응 공학, 송승구 외 3명 역, 희중당, p.98~105
3. 유기 화학, R.T.Fessenden, 자유아카데미, p.177~181
4. 유기 화학, C.Vollhart, 탐구당, p.233~235
5. 일반 화학, James E. Brady, 탐구당, p.645~646
6. 일반 화학 실험, 화학교재 편찬위원회, p.151~154















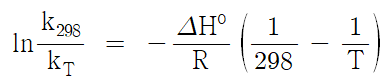





!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글