실험 목적
박층크로마토그래피(TLC: Thin Layer Chromatography)로 식물의 광합성 색소를 분리하고 각 분획별 색소의 이화학적 특성을 조사한다.
실험 이론 및 원리
광합성은 식물세포 내 엽록체에서 일어나며, 일반적으로 두 단계로 나뉜다. 광의존반응과 광독립반응. 광의존반응에서는 빛에너지를 받아들이고 에너지(ATP)를 생성한다. 또한 반응의 부산물인 산소를 기공을 통하여 배출한다. 이 산소는 대부분의 생물들이 세포호흡을 하는 데 사용된다. 그리고 광독립반응에서는 식물은 기공을 통하여 이산화탄소를 흡수한 후에, 당을 만드는 데 사용한다. 아래 그림처럼 광의존반응과 광독립반응 각각의 생성물은 각각의 반응물이다. 따라서 두 과정 중 한 과정이 멈추게 되면 광합성도 멈추게 된다.
 |
| 광합성의 과정 |
광의존 반응에서는 산소를 방출하고, ATP와 NADPH를 생성한다. 광독립 반응에서는 광의존반응에서 생성된 ATP와 NADPH를 이용하여 CO2를 고정시키고 당을 만든다. 두 과정은 상호보완적이어서, 한 과정이 멈추면 다른 과정도 멈춘다. 주로 두 과정 모두 햇빛이 있는 낮에 일어난다.
2. 광합성 색소
1) 엽록소a
엽록소a는 광합성을 하는 대부분의 생물체에서 발견되는 광합성 색소이다. 긴 소수성의 가지와 탄소고리 구조를 가지며 탄소고리 가운데에는 마그네슘 원자를 가지고 있다(그림1). 탄소고리모양의 구조에서 빛을 흡수한다. 엽록소a가 가장 잘 흡수하는 파장은 430㎚, 663㎚이다.
2) 엽록소b
엽록소b는 주로 녹조류와 식물에서만 발견된다. 기본적인 구조의 틀은 엽록소a와 같지만, 엽록소a가 탄소고리부분에 가지는 메틸기가 알데히드기로 치환되어있다(그림1). 엽록소b의 흡수파장은 455㎚, 645㎚이다.
3) 카로티노이드
카로티노이드는 일반적으로 40개의 탄소 원자를 가지고 있는 길다란 구조이다(그림2). 카로티노이드는 엽록소와 다른 파장을 흡수하기 때문에 광합성에 사용될 수 있는 파장의 범위를 넓혀준다. 사과나 앵두 같은 과일의 붉은 기는 이 카로티노이드 때문이다. 또한 단풍잎의 빨간색도 카로티노이드 때문인데, 이는 카로티노이드를 제외한 엽록소a와 엽록소b가 가을철에 분해되어 색이 없어지고, 카로티노이드만 남기 때문이다. 카로티노이드의 주된 흡수파장은 450~500㎚이다.
그림1 엽록소a와 b의 구조 | 그림2 카로티노이드의 구조 |
 |
| 그림3 광합성 색소의 흡수스펙트럼 |
3. 크로마토그래피
크로마토그래피는 용액에 들어있는 성분을 분자량에 따라 나누어 성분을 분석하는 방법이다. 크로마토그래피 종이에 분석할 시료를 바르고, 아래쪽에 전개용액을 적셔서 세워두면, 모세관 현상에 의해 용액이 종이를 타고 올라간다. 이 때 분자량이 작은 물질일수록 더 가벼우므로 전개원점으로부터 더 먼 곳까지 전개된다. 이번 실험에서는 분자량이 가장 작은 카로틴이 가장 원점으로부터 멀리 이동할 것으로 추측된다.
4. 분광광도계
분광광도계란 시료를 투과한 빛의 세기를 측정하는 장치이다. 단순히 빛을 투과시키는 것은 아니고, 특정한 파장의 빛을 시료에 쬐어준다. 그 특정한 파장은 시료마다 각기 다르게 정해져 있으며, 시료를 구성하는 분자의 전자궤도와 에너지준위에 기인한다. 또한 분광광도계에 시료를 넣어 측정할 때엔 큐벳이라는 용기를 사용한다. 큐벳에 시료를 넣을 때, 큐벳 안에 공기방울이 들어갔는지, 큐벳 겉에 지문이나 이물질이 묻었는지, 곡 확인해야한다. 빛을 큐벳에 쬐어 통과시키기 때문에 큐벳 안에서 빛의 굴절이 일어나면 실험 결과에 영향을 미치게 된다. 이렇게 분광광도계를 이용하여 측정한 값을 흡광도라 하는데, 이는 시료가 빛을 얼마나 흡수했는가(또는 얼마나 투과했는가)를 나타내는 값이다.
5. 전개율(Rf)
전개율은 (특정 색소가 이동한 거리/전개액이 이동한 거리)로 정의한다. 식이 의미하듯이 시료가 전개용매와 섞여서 이동하는 정도를 나타내는 값이다. 비율이므로 단위는 없다. 분자량이 작은 물질일수록 크로마토그래피 종이 상에서 더 멀리 이동하므로 전개율이 크다. 또한 분모가 전개액이 이동한 거리 이므로, 전개율은 1보다 더 클 수 없다.
실험 기구 및 시약
1) 크로마토그래피 종이, 시험관, 막자와 사발, 분광광도계, 파이펫, 스포이트
2) 전개용매(에테르, 아세톤의 9:1 비율), 시금치 잎, 아세톤, 에테르
실험 방법
1) 일정량의 시금치 잎(1g 정도로 시금치 잎 두 장 정도면 충분)을 유발에 넣고 아세톤 5㎖를 첨가한 후, 막자사발로 곱게 간다.
2) 세포잔사를 제거하지 않은 상태에서 다음 단계인 크로마토그래피에 사용한다.
2. 크로마토그래피에 의한 색소의 분획
1) 여과지를 15 x 2㎝ 되게 자른다. 아래 그림과 같이 1㎝되는 곳을 잘라 삼각형을 만든 다음 이곳으로부터 2㎝되는 곳에 연필로 선을 긋는다. 이때 여과지를 손으로 만지지 않도록 한다.
2) 모세관을 이용하여 준비된 엽록소 추출액을 연필로 그은 선 중앙에 점적한다.
3) 핀으로 여과지를 시험관 마개에 매달고 전개 용매가 들어있는 시험관에 넣는다. 여과지가 시험관 벽면에 달지 않도록 주의하고 전개용매의 끝에서 0.5㎝정도 잠기도록 한다.
4) 전개액이 여과지 위에서 충분히 전개될 때까지 기다린다.
5) 점적한 부분에서 가장 가까운 곳의 노란색을 띤 녹샌의 밴드가 엽록소b이고 그 위에 푸른색을 띤 녹색밴드가 엽록소a이며 그 위쪽으로 몇 개의 크산토필 밴드가 나타난다. 전개액이 전개된 가장 위쪽의 노란색 밴드가 카로틴이다. 각각의 밴드의 Rf값을 다음의 식으로부터 구한다.
Rf = 특정 색소가 이동한 거리/전개액이 이동한 거리
6) 다른 색소 밴드가 섞이지 않도록 주의하며 엽록소a를 잘라 내어 시험관에 넣고 아세톤 2㎖을 부어 유리막대로 잘 저어준다.
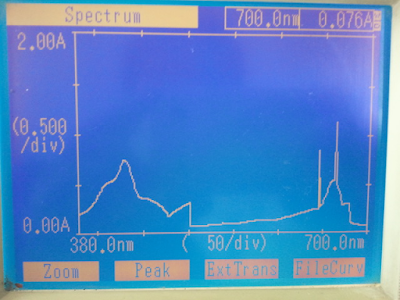
7) 분광광도계를 이용하여 380㎚에서 700㎚까지의 파장에서 20㎚ 간격으로 흡광도를 측정하여 그래프를 그리고 최대흡수파장을 알아본다.
3. 엽록소의 함량 측정
1) 시금치 잎에서 추출한 엽록소a와 엽록소b의 혼합물을 아세톤으로 적당히 희석하고 분광광도계를 이용하여 645㎚와 663㎚에서 흡광도를 측정한다.
2) 식을 이용하여 엽록소의 함량을 구한다.
실험 결과
1. 광합성 색소의 분획 결과
색소 | 이동거리 | Rf값 | 비고(밴드의 색 등) |
전개용매 | 8㎝ | 1 | 투명색 |
엽록소a | 3.5㎝ | 0.44 | 옅은 녹색 |
엽록소b | 5㎝ | 0.62 | 가장 짙은 녹색 |
카로틴 | 7.5㎝ | 0.94 | 옅은 노란색 |
크산토필 | 6.4㎝ | 0.80 | 옅은 노란색 |
2. 엽록소a의 흡광도 측정 결과
파장 | 흡광도 | 파장 | 흡광도 | 파장 | 흡광도 |
380㎚ | 0.491 | 500㎚ | 0.309 | 620㎚ | 0.256 |
400㎚ | 0.760 | 520㎚ | 0.092 | 640㎚ | 0.247 |
420㎚ | 1.001 | 540㎚ | 0.114 | 660㎚ | 1.047 |
440㎚ | 0.695 | 560㎚ | 0.125 | 680㎚ | 0.311 |
460㎚ | 0.194 | 580㎚ | 0.176 | 700㎚ | 0.080 |
480㎚ | 0.190 | 600㎚ | 0.188 | | |
3. 흡광도 곡선을 그래프로 그리고 엽록소a의 최대흡수파장 측정
4. 엽록소b의 흡광도 측정 결과
파장 | 흡광도 | 파장 | 흡광도 | 파장 | 흡광도 |
380㎚ | 0.401 | 500㎚ | 0.309 | 620㎚ | 0.259 |
400㎚ | 0.480 | 520㎚ | 0.142 | 640㎚ | 0.784 |
420㎚ | 0.950 | 540㎚ | 0.190 | 660㎚ | 0.378 |
440㎚ | 1.452 | 560㎚ | 0.205 | 680㎚ | 0.311 |
460㎚ | 1.926 | 580㎚ | 0.235 | 700㎚ | 0.101 |
480㎚ | 0.528 | 600㎚ | 0.285 | | |
5. 흡광도 곡선을 그래프로 그리고 엽록소b의 최대흡수파장 측정
6. 엽록소 함량 측정의 결과
흡광도 | 645㎚ | 39.7 |
663㎚ | 88.8 | |
전체 엽록소 함량 | 1.51 | |
토의 사항
카로틴(carotene, C40H56)의 분자량은 536g/㏖, 크산토필(Xanthophyll, C40H56O2)의 분자량은 568g/㏖, 엽록소a (C55H72O5N4Mg)의 분자량은 892g/㏖, 엽록소b (C55H70MgN4O6)의 분자량은 906g/㏖이다.
예상대로 분자량이 가장 작은 카로틴이 가장 많이 이동하였으며, 전개용매와 거의 이동한 거리가 같았다. 이로부터 실험에 사용한 전개용매의 분자량이 카로틴의 분자량과 거의 같다고 가정할 수 있었으며 실제로 계산해 보았다. 실험에 사용한 전개용매는 에테르(디에틸에테르)와 아세톤을 9:1로 섞은 것이다. 에테르((C2H5)2O)의 분자량은 74g/㏖, 아세톤(C3H6O)의 분자량은 58g/㏖이다.
따라서 전개용매의 분자량은 74×0.9 + 58×0.1 = 72.4이다. 이는 카로틴의 분자량보다 현저히 작은 값이므로 가정이 틀렸다. 이 이유는 크로마토그래피 종이에서 전개현상이 일어날 때, 분자량뿐만 아니라 용액성분의 점성도도 이동거리에 관여하기 때문으로 추측된다. 엽록소a와 엽록소b는 분자량이 14밖에 차이가 나지 않는데도 비교적 큰 이동거리의 차가 나타났다.
또한 엽록소a와 b의 흡광도 그래프로부터 엽록소a, b는 붉은색과 보라색 쪽의 파장의 빛을 많이 흡수함을 알 수 있었다. 이 파장의 빛을 광합성에 이용하고 나머지 파장의 빛은 반사시킴으로서 식물의 잎이 녹색을 띠게 된다는 사실도 확인할 수 있었다. 만약 실험에서 카로틴의 색소 부위를 잘라 분광광도계에 넣었다면, 흡광도는 480~500㎚ 사이에서 가장 큰 값을 가지는 결과가 나왔을 것이다.
참고 문헌
1. 생명과학 - 역동적인 자연과학, P. J. Russell, 홍영남 외 역, 라이프사이언스, 2009, p.183~186





!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글