실험 목적
밀폐된 실린더에 공기를 채운 후 온도, 부피, 압력을 변화시키면서 이상기체 상태방정식을 확인하고, 온도를 일정하게 유지한 채 압력을 변화시키면서 부피를 측정하여 Boyle 법칙을 확인한다.
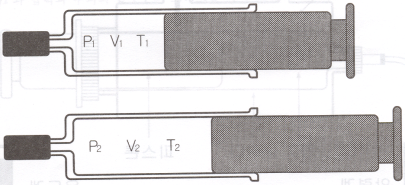 |
변화 전 (위)와 변화 후 (아래)모습 |
실험 이론 및 원리
1. 실험 원리
압력 P, 부피 V, 분자수 N, 온도 T인 기체가 열적 평형상태에 있으면, 기체의 상태방정식에 의해 서로 관련이 맺어진다. 이상기체의 경우 상태 방정식은 다음과 같다.
PV=kNT (1)
k : Boltzmann 상수
이 방정식은 많은 기체의 성질을 놀라운 정도로 만족시킨다. 특히 온도가 높거나 밀도가 낮으면 (N/V가 작으면) 더욱 잘 만족시킨다. 그림과 같이 피스톤 내부에 있는 기체의 압력, 부피 그리고 온도를 변화시켰다면 기체 분자수는 일정하므로,
P1V1/T1 = P2V2/T2 = Nk = 일정 (2)
하게 된다.
만약, 변화 전과 변화 후의 기체 온도를 일정하게 유지 시켰다면,
P1V1 = P2V2 = 일정 (3)
하게 된다. 이 관계식이 Boyle의 법칙이라고 알려져 있다.
실험 기구 및 장치
1. 실험 재료
1) Boyle의 법칙 실험 장치, 디지털 압력계, 디지털 온도계, 알콜 램프
 |
Boyle의 법칙 실험 장치 |
실험 방법
1. Boyle의 법칙 (PV=일정)
1) 그림과 같이 장치를 하고 내부 압력이 대기압과 같을 때 피스토이 실린더 중앙에 오도록 맞춘다. (중앙에 있지 않으면 압력계의 연결 호스를 뽑아서 피스톤이 중앙에 오도록 학고 다시 호스를 결합한다.)
2) 피스톤을 5㎖정도 압축한다. 계속 이 상태를 유지하면서 공기가 새는지 확인한다. (공기가 새면 압력이 계속해서 낮아진다.)
3) 공기가 새지 않으면 실린더의 눈금을 단계별로 정하여 공기를 압축시키면서 압력을 측정하고 다시 팽창시키면서 압력을 측정한다.
4) 압축시킬 때와 팽창시킬 때 측정한 압력과 부피의 곱 PV를 각각 계산한다.
5) 부피의 역수 1/V에 따른 압력의 그래프를 각각 그린다.
2. 이상기체의 상태 방정식 (PV/T=일정)
1) 실린더의 내부 압력을 대기압과 같게 맞추고 바깥 유리통(Glass Jacket)에 물을 채운다.
2) 알콜 램프로 바깥 유리통을 가열하면서 공기의 온도, 압력, 부피를 측정한다.
3) 지정된 온도가 되면 알콜 램프의 불을 끄고 온도를 내리면서 공기의 온도, 압력 부피를 측정한다.
4) 온도를 올릴 때와 내릴 때의 PV/T를 각각 계산한다.
5) 온도 T와 압력과 부피의 곱 PV의 그래프를 각각 그린다.
실험 결과
1. 측정값
1) Boyle의 법칙 (PV=일정)
1mbar = 103dyne/㎠ = 102Pa = 102N㎡ | 1㎖ = 10-6㎥ |
∴ 1mbar·㎖ = 1×10-4N·m | |
압 축 과 정 | 팽 창 과 정 | ||||||
| P(mbar) | V(㎖) | PV(×10-4N·m) | | P(mbar) | V(㎖) | PV(×10-4N·m) |
1 | 999 | 50 | 49950 | 1 | 999 | 50 | 49950 |
2 | 1056 | 47 | 49632 | 2 | 943 | 53 | 49979 |
3 | 1102 | 45 | 49590 | 3 | 912 | 55 | 50160 |
4 | 1150 | 43 | 49450 | 4 | 880 | 57 | 50160 |
5 | 1235 | 40 | 49400 | 5 | 838 | 60 | 50280 |
6 | 1320 | 37 | 48840 | 6 | 800 | 63 | 50400 |
7 | 1387 | 35 | 48545 | 7 | 776 | 65 | 50440 |
8 | 1455 | 33 | 48015 | 8 | 753 | 67 | 50451 |
9 | 1595 | 30 | 47850 | 9 | 723 | 70 | 50610 |
10 | 1758 | 27 | 47466 | 10 | 696 | 73 | 50808 |
11 | 1878 | 25 | 46950 | 11 | 677 | 75 | 50775 |
| | 12 | 660 | 77 | 50820 | ||
13 | 635 | 80 | 50800 | ||||
평 균 및 표준오차 : PV = 49624.82±190.69(×10-4N·m/K) | |||||||
2) 이상기체 상태 방정식 (PV/T=일정)
1mbar = 103dyne/㎠ = 102Pa = 102N㎡ | 1㎖ = 10-6㎥ |
∴ 1mbar·㎖ = 1×10-4N·m | |
T(K) = Tc(℃) + 273.15
가 열 과 정 | 가 열 과 정 | ||||||||
Tc (℃) | T (K) | P (mbar) | V (㎖) | PV/T (×10-4N·m/K) | Tc (℃) | T (K) | P (mbar) | V (㎖) | PV/T (×10-4N·m/K) |
15 | 288.15 | 1000 | 50.0 | 173.5207357 | 54 | 327.15 | 1024 | 56.0 | 175.2835091 |
16 | 289.15 | 1000 | 50.0 | 172.9206294 | 55 | 328.15 | 1024 | 56.2 | 175.3734573 |
17 | 290.15 | 1001 | 50.0 | 172.4969843 | 56 | 329.15 | 1023 | 56.2 | 174.6699073 |
18 | 291.15 | 1002 | 50.0 | 172.0762494 | 57 | 330.15 | 1023 | 56.5 | 175.0704225 |
19 | 292.15 | 1004 | 50.0 | 171.8295396 | 58 | 331.15 | 1022 | 56.9 | 175.6056168 |
20 | 293.15 | 1007 | 50.0 | 171.7550742 | 59 | 332.15 | 1021 | 57.0 | 175.2130062 |
21 | 294.15 | 1011 | 50.0 | 171.8510964 | 60 | 333.15 | 1021 | 57.1 | 174.9935465 |
22 | 295.15 | 1014 | 50.0 | 171.7770625 | 61 | 334.15 | 1021 | 57.3 | 175.0809517 |
23 | 296.15 | 1018 | 50.0 | 171.8723620 | 62 | 335.15 | 1021 | 57.6 | 175.4724750 |
24 | 297.15 | 1022 | 50.0 | 171.9670200 | 63 | 336.15 | 1021 | 57.9 | 175.8616689 |
25 | 298.15 | 1026 | 50.0 | 172.0610431 | 64 | 337.15 | 1021 | 58.9 | 178.3683820 |
26 | 299.15 | 1027 | 50.1 | 171.9963229 | 65 | 338.15 | 1020 | 58.0 | 174.9519444 |
27 | 300.15 | 1029 | 50.2 | 172.0999500 | 66 | 339.15 | 1020 | 58.0 | 174.4360902 |
28 | 301.15 | 1030 | 50.2 | 171.6951685 | 67 | 340.15 | 1020 | 58.2 | 174.5230046 |
29 | 302.15 | 1031 | 50.3 | 171.6342876 | 68 | 341.15 | 1019 | 58.6 | 175.0356148 |
30 | 303.15 | 1031 | 50.3 | 171.0681181 | 69 | 342.15 | 1019 | 59.0 | 175.7153295 |
31 | 304.15 | 1032 | 50.5 | 171.3496630 | 70 | 343.15 | 1019 | 59.0 | 175.2032639 |
32 | 305.15 | 1032 | 51.0 | 172.4791086 | 71 | 344.15 | 1019 | 59.1 | 174.9902659 |
33 | 306.15 | 1032 | 51.2 | 172.5899069 | 72 | 345.15 | 1018 | 59.3 | 174.9019267 |
34 | 307.15 | 1032 | 51.6 | 173.3719681 | 73 | 346.15 | 1017 | 59.5 | 174.8129424 |
35 | 308.15 | 1032 | 51.9 | 173.8140516 | 74 | 347.15 | 1016 | 60.0 | 175.6013251 |
36 | 309.15 | 1032 | 52.1 | 173.9194566 | 75 | 348.15 | 1015 | 60.2 | 175.5076835 |
37 | 310.15 | 1031 | 52.2 | 173.5231340 | 76 | 349.15 | 1015 | 60.5 | 175.8771302 |
38 | 311.15 | 1030 | 52.5 | 173.7907762 | 77 | 350.15 | 1015 | 60.5 | 175.3748394 |
39 | 312.15 | 1030 | 52.8 | 174.2239308 | 78 | 351.15 | 1015 | 61.0 | 176.3206607 |
40 | 313.15 | 1029 | 53.0 | 174.1561552 | 79 | 352.15 | 1015 | 61.0 | 175.8199631 |
41 | 314.15 | 1028 | 53.2 | 174.0875378 | 80 | 353.15 | 1015 | 61.2 | 175.8969277 |
42 | 315.15 | 1027 | 53.5 | 174.3439632 | 81 | 354.15 | 1015 | 61.3 | 175.6868559 |
43 | 316.15 | 1027 | 53.8 | 174.7670410 | 82 | 355.15 | 1015 | 61.6 | 176.0495565 |
44 | 317.15 | 1026 | 54.0 | 174.6933628 | 83 | 356.15 | 1015 | 61.9 | 176.4102204 |
45 | 318.15 | 1026 | 54.2 | 174.7892504 | 84 | 357.15 | 1015 | 62.0 | 176.2004760 |
46 | 319.15 | 1025 | 54.4 | 174.7140843 | 85 | 358.15 | 1014 | 62.0 | 175.5353902 |
47 | 320.15 | 1025 | 54.8 | 175.4490083 | 86 | 359.15 | 1014 | 62.5 | 176.4583043 |
48 | 321.15 | 1025 | 54.9 | 175.2218589 | 87 | 360.15 | 1014 | 62.8 | 176.8129946 |
49 | 322.15 | 1025 | 55.0 | 174.9961198 | 88 | 361.15 | 1014 | 62.9 | 176.6041811 |
50 | 323.15 | 1025 | 55.1 | 174.7717778 | 89 | 362.15 | 1013 | 63.1 | 176.5022781 |
51 | 324.15 | 1025 | 55.3 | 174.8650316 | 90 | 363.15 | 1013 | 63.2 | 176.2951948 |
52 | 325.15 | 1024 | 55.6 | 175.1019529 | 91 | 364.15 | 1012 | 63.5 | 176.4712344 |
53 | 326.15 | 1024 | 55.9 | 175.5069753 | 92 | 365.15 | 1012 | 63.8 | 176.8193893 |
냉 각 과 정 | 냉 각 과 정 | ||||||||
Tc (℃) | T (K) | P (mbar) | V (㎖) | PV/T (×10-4N·m/K) | Tc (℃) | T (K) | P (mbar) | V (㎖) | PV/T (×10-4N·m/K) |
30 | 303.15 | 977 | 54.0 | 174.03266 | 61 | 334.15 | 981 | 59.8 | 175.56127 |
31 | 304.15 | 976 | 54.2 | 173.92471 | 62 | 335.15 | 982 | 59.9 | 175.50888 |
32 | 305.15 | 976 | 54.7 | 174.95396 | 63 | 336.15 | 983 | 60.0 | 175.45739 |
33 | 306.15 | 976 | 55.0 | 175.33889 | 64 | 337.15 | 983 | 60.1 | 175.22853 |
34 | 307.15 | 977 | 55.0 | 174.94709 | 65 | 338.15 | 983 | 60.3 | 175.29173 |
35 | 308.15 | 978 | 55.0 | 174.55785 | 66 | 339.15 | 983 | 60.5 | 175.35456 |
36 | 309.15 | 977 | 55.2 | 174.44736 | 67 | 340.15 | 983 | 60.8 | 175.70601 |
37 | 310.15 | 976 | 55.5 | 174.65098 | 68 | 341.15 | 984 | 61.0 | 175.94606 |
38 | 311.15 | 976 | 55.8 | 175.03069 | 69 | 342.15 | 984 | 61.0 | 175.43183 |
39 | 312.15 | 977 | 56.0 | 175.27471 | 70 | 343.15 | 984 | 61.0 | 174.92059 |
40 | 313.15 | 978 | 56.0 | 174.89382 | 71 | 344.15 | 982 | 61.5 | 175.48453 |
41 | 314.15 | 978 | 56.0 | 174.33710 | 72 | 345.15 | 982 | 61.7 | 175.54513 |
42 | 315.15 | 978 | 56.3 | 174.71490 | 73 | 346.15 | 983 | 62.0 | 176.06818 |
43 | 316.15 | 978 | 56.5 | 174.78096 | 74 | 347.15 | 984 | 62.0 | 175.73959 |
44 | 317.15 | 976 | 57.0 | 175.41227 | 75 | 348.15 | 985 | 62.1 | 175.69582 |
45 | 318.15 | 975 | 57.0 | 174.68175 | 76 | 349.15 | 985 | 62.2 | 175.47472 |
46 | 319.15 | 976 | 57.0 | 174.31302 | 77 | 350.15 | 985 | 62.5 | 175.81751 |
47 | 320.15 | 977 | 57.4 | 175.16727 | 78 | 351.15 | 986 | 62.7 | 176.05639 |
48 | 321.15 | 978 | 57.5 | 175.10509 | 79 | 352.15 | 986 | 63.0 | 176.39642 |
49 | 322.15 | 978 | 57.8 | 175.47230 | 80 | 353.15 | 987 | 63.0 | 176.07532 |
50 | 323.15 | 978 | 58.0 | 175.53458 | 81 | 354.15 | 987 | 63.0 | 175.57814 |
51 | 324.15 | 978 | 58.1 | 175.29477 | 82 | 355.15 | 987 | 63.2 | 175.63959 |
52 | 325.15 | 978 | 58.3 | 175.35722 | 83 | 356.15 | 987 | 63.5 | 175.97782 |
53 | 326.15 | 978 | 58.5 | 175.41929 | 84 | 357.15 | 987 | 63.7 | 176.03780 |
54 | 327.15 | 978 | 58.9 | 176.07886 | 85 | 358.15 | 987 | 64 | 176.37303 |
55 | 328.15 | 977 | 59.0 | 175.66052 | 86 | 359.15 | 989 | 64 | 176.23834 |
56 | 329.15 | 976 | 59.0 | 174.94759 | 87 | 360.15 | 992 | 64 | 176.28210 |
57 | 330.15 | 979 | 59.0 | 174.95381 | 88 | 361.15 | 997 | 64 | 176.68005 |
58 | 331.15 | 978 | 59.2 | 174.83799 | 89 | 362.15 | 999 | 64 | 176.54563 |
59 | 332.15 | 980 | 59.5 | 175.55321 | 90 | 363.15 | 1001 | 64 | 176.41195 |
560 | 333.15 | 981 | 59.7 | 175.79379 | 91 | 364.15 | 1005 | 64 | 176.63051 |
평균 및 표준오차 : PV/T = 174.911±0.084(×10-4N·m/K) | |||||||||
2. 결과 분석
1) Boyle의 법칙(PV=일정)
실험실의 대기압은 P0 = 999mbar = 999×102N/㎡이였고, 이때 피스톤의 부피를 V0 = 50㎖ = 50×10-6㎥로부터 실험을 시작했다. 부피를 압축하는 과정과 팽창하는 과정에서 부피 변화에 따른 피스톤 내부 압력변화를 측정하였는데, 그 결과는 다음과 같다.
압축과정 : PV압축 = 48698.909±255.931(×10-4N·m/K)
팽창과정 : PV압축 = 50433.308±71.294(×10-4N·m/K)
이 두 과정을 통합해서 볼 때, 부피가 감소할수록 PV값들이 감소하는 경향을 보이고 있었다. 이것은 피스톤이 완전 밀폐가 되지 않았고, 부피가 감소할수록 피스톤 내부의 공기가 빠져나가 내부압력이 축소되어 측정되고, 부피가 증가할수록 피스톤 내부로 공기가 들어와 압력이 높게 측정되었기 때문이라 생각된다. 그리고 두 과정을 통합한 결과는 다음과 같다.
PV = 49624.82±190.69(×10-4N·m/K)
2) 이상기체 상태 방정식 (PV/T=일정)
실험실의 대기압은 P0 = 1000mbar = 1000×102N/㎡이였고, 이때 피스톤의 부피를 V0 = 50㎖ = 50×10-6㎥, 온도를 T0 = 15℃ = 288.15K에서 실험을 시작하였다. 온도를 올리는 가열과정과 반대의 냉각과정을 거치면서 온도변화에 따른 피스톤의 부피와 내부압력을 측정하였다. 그 결과는 다음과 같다.
가열과정 : PV/T가열 = 17.499±0.143(×10-4N·m/K)
냉각과정 : PV/T냉각 = 175.429±0.063(×10-4N·m/K)
그리고 두 과정을 통합한 결과는 다음과 같다.
PV/T = 174.911±0.084(×10-4N·m/K)
토의 사항
1. 질문 사항
1) 실험 a에서 P와 1/V의 그래프를 그리고 의미를 설명하시오.
위의 그래프에서처럼 x축을 1/V로 하고 y축을 P로 했을 때, 그 기울기가 PV값에 해당한다. 위 그래프에서 최소자승법을 이용하여, 직선의 방정식을 구해보면 다음과 같고,
P = 4.5539(1/V) + 7869.9
여기서 기울기가 PV값에 해당하고, PV기울기 = 45539(×10-4N·m/K)이고, 계산값 PV = 49624.82±190.69(×10-4N·m/K)와는 큰 차이를 보인다. 따라서 그래프에서 V=∞일 때, P=0인 점을 지나도록 해서 최소자승법으로 기울기를 구해보면, PV∞ = 48785N·m가 되고, 이것은 계산한 값과 비슷하다.
실험에서 피스톤 안에는 이상기체가 아닌 공기가 들어 있었기 때문에, 분자간 인력이나, 공기분자의 부피가 있음을 고려할 때, PV기울기 = 45539(×10-4N·m/K)가 PV∞ = 48785N·m보다 더 타당한 것으로 보인다.
2) 실험 b에서 PV와 T의 그래프를 그리고 의미를 설명하시오.
위의 그래프에서처럼 x축을 T로 하고 y축을 PV로 했을 때, 그 기울기가 PV/T값에 해당한다. 위 그래프에서 최소자승법을 이용하여, 직선의 방정식을 구해보면 다음과 같고,
PV = 0.0195T-0.6626 (가열과정)
PV = 0.0185T-0.327 (냉각과정)
여기서 기울기가 우리가 구한 PV값에 해당하고, PV/T기울기-가열 = 195(×10-4N·m/K), PV/T기울기-냉각 = 185(×10-4N·m/K)이고, 계산값 PV/T=174.911±0.084(×10-4N·m/K)와는 큰 차이를 보인다. 따라서 그래프에서 T=0일 때, PV=0인 점을 지나도록 해서 최소자승법으로 기울기를 구해보면, PV0 = 175×10-4N·m/K가 되고, 이것은 계산한 값과 비슷하다. 실험에서 피스톤 안에는 이상기체가 아닌 공기가 들어 있었기 때문에, 분자간 인력이나, 공기분자의 부피가 있음을 고려할 때, 직접 계산한 값보다는 그래프에서 읽은 값이 더 타당하다.
2. 실험 고찰
본 실험은 밀폐된 실린더에 공기를 채운 후 온도, 부피, 압력을 변화시키면서 이상기체 상태방정식을 확인하고, 온도를 일정하게 유지한 채 압력을 변화시키면서 부피를 측정하여 Boyle 법칙을 확인하는 것이다.
보일의 법칙에서 PV기울기 = 45539(×10-4N·m/K)로서 일정한 값을 확인할 수 있었고, 이상기체방정식에서 PV/T기울기-가열 = 195(×10-4N·m/K)가 일정한 값을 가짐을 확인할 수 있었다.
하지만, 이상기체에 관하여 계산 한 값들과는 상당한 차이를 보이고 있는데, 이것은 실린더 내부에는 이상기체가 아닌 공기가 채워져 있었고, 따라서 Van der Waals 방정식을 적용하는게 더 타당하다.
여기서 a/V2항은 분자력 때문에 나타나는 항이고, b는 분자 자신이 점유하는 체적에 비례하는 것이다. 또한 실린더의 완전밀폐는 불가능 하기때문에 오차가 발생한다.






!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글