실험 결과
1. 결과 분석
1) 매 적정 종말점에서의 용액 조성의 무게%와 몰분율, 종말점까지 사용된 물, 톨루엔, 아세톤의 총 양을 X, Y, Z ㎖ 이라 하면 조성은 다음 식으로 구할 수 있다.
물의 wt% = 0.998X/(0.998X+0.866Y+0.792Z)×100
물의 몰분율 = (0.998X/18)/{(0.998X/18)+(0.866Y/92)+(0.792Z/58)}
1. 물 1㎖+톨루엔 9㎖ | | | | | | | | | | ||||||||||
횟 수 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||||||
물(㎖) | 1 | 2 | 3.1 | 4 | 5 | 6 | 7 | 8 | 9 | 10.04 | |||||||||
톨 루 엔(㎖) | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | |||||||||
적정아세톤양(㎖) | 13 | 19 | 23 | 25.9 | 28.5 | 30.8 | 32.8 | 34.8 | 36.4 | 38.4 | |||||||||
물의 wt% | 5.228 | 8.036 | 10.630 | 12.360 | 14.114 | 15.685 | 17.140 | 18.422 | 19.695 | 20.777 | |||||||||
톨루엔의 wt% | 40.832 | 31.379 | 26.780 | 24.131 | 22.044 | 20.416 | 19.123 | 17.984 | 17.090 | 16.161 | |||||||||
아세톤의 wt% | 53.940 | 60.585 | 62.590 | 63.509 | 63.842 | 63.898 | 63.737 | 63.594 | 63.214 | 63.062 | |||||||||
물의 몰분율 | 0.175 | 0.244 | 0.301 | 0.336 | 0.369 | 0.397 | 0.422 | 0.442 | 0.462 | 0.478 | |||||||||
톨루엔의 몰분율 | 0.267 | 0.186 | 0.148 | 0.128 | 0.113 | 0.101 | 0.092 | 0.084 | 0.078 | 0.073 | |||||||||
아세톤의 몰분율 | 0.559 | 0.570 | 0.550 | 0.536 | 0.518 | 0.502 | 0.486 | 0.474 | 0.460 | 0.450 | |||||||||
2. 물 9㎖ + 톨루엔 1㎖ | | | | | | | | | | ||||||||||
횟 수 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||||||
물(㎖) | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | |||||||||
톨 루 엔(㎖) | 1 | 2 | 3.04 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||||||
적정아세톤양(㎖) | 13.7 | 18.4 | 21.4 | 24.1 | 26.9 | 29.5 | 32 | 34.3 | 36.8 | 39.1 | |||||||||
물의 wt% | 43.395 | 35.521 | 31.446 | 28.484 | 25.947 | 23.925 | 22.239 | 20.852 | 19.559 | 18.478 | |||||||||
톨루엔의 wt% | 4.184 | 6.849 | 9.217 | 10.985 | 12.508 | 13.840 | 15.009 | 16.083 | 16.972 | 17.816 | |||||||||
아세톤의 wt% | 52.421 | 57.630 | 59.337 | 60.530 | 61.545 | 62.234 | 62.751 | 63.065 | 63.468 | 63.706 | |||||||||
물의 몰분율 | 0.717 | 0.649 | 0.609 | 0.576 | 0.546 | 0.521 | 0.498 | 0.479 | 0.459 | 0.443 | |||||||||
톨루엔의 몰분율 | 0.014 | 0.024 | 0.035 | 0.043 | 0.052 | 0.059 | 0.066 | 0.072 | 0.078 | 0.084 | |||||||||
아세톤의 몰분율 | 0.269 | 0.327 | 0.356 | 0.380 | 0.402 | 0.420 | 0.436 | 0.449 | 0.463 | 0.474 | |||||||||
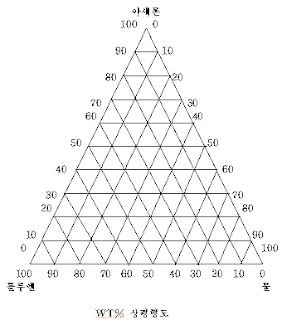
2) 정삼각형 좌표
① 톨루엔 9㎖에 물 1㎖ 씩을 첨가한 경우
② 물 9㎖에 톨루엔 1㎖ 씩을 첨가한 경우
3) 임계점
(임계점은 실험자료를 바탕으로 위의 그래프에 작성하면 됨)
토의 사항
1. 실험 고찰
본 실험은 물, 톨루엔, 아세톤으로 이루어진 3성분 액상계의 종말점을 찾고 이 액상의 상평형도를 정삼각형 좌표계에 나타냄으로써 3성분 액상계의 상평형 거동과 정삼각형 좌표계를 이해하는 실험이다.
액체-액체 혼합계로써 먼저 물과 톨루엔을 삼각 플라스크에 넣으면 이 두 액체는 두 층으로 나뉜다. 극성인 액체(물)와 비극성인 액체(톨루엔)를 혼합하였을 경우에는 섞이지 않기 때문이다. 섞이지 않고 두 층으로 나뉘어진 삼각 플라스크에 아세톤을 조금씩 가하면 어느 한 층의 부피가 점점 줄어들면서 두 층이 서로 용해되어 섞이기 시작하고 종말점에 도달하면 한 층으로 합쳐진다.
본 실험은 톨루엔 9㎖에 물 1㎖ 씩을 첨가하는 실험과 물 9㎖에 톨루엔 1㎖ 씩을 첨가하는 실험으로 두 가지를 실험을 하는 것이다. 우리 조는 세명이어서 두명은 실험을 하나씩 맡아 실행하고 한명이 데이터를 적는 것으로 분담을 하여 실험을 했다. 나는 물 1㎖씩을 톨루엔 9㎖에 첨가하는 실험을 맡아서 실행했다. 처음의 적정에서 물 1㎖와 톨루엔 9㎖이 섞여 있을 때 적정에 필요한 아세톤의 양을 10㎖라 생각하고 과감히 넣었다. 그래도 적정이 되지 않고 두 층으로 나뉘어 있었다. 그 후 나는 1㎖씩을 첨가 해보았다. 이런 식으로 하여 13㎖의 아세톤을 넣자 두 액체가 혼합되었다. 또 1㎖의 물을 첨가하여 두 층으로 분리된 물과 톨루엔을 아세톤으로 다시 적정하였다.
본 실험에서는 아주 미세한 양의 아세톤이라도 초과하여 가한다면 종말점을 금새 임계점을 지나쳐 버렸다. 이러한 이유로 내가 실행한 실험에서 나는 10번 중 5번을 적정에 실패했다. 적정에서 임계점을 지나치면 혼합물이 투명해 진다. 이럴 경우 소량의 물이나 톨루엔을 가하면 다시 두 층으로 나뉘게 된다. 그러면 다시 아세톤으로 적정하면 된다. 내가 한 실험은 그나마 물과 톨루엔의 층 구분이 쉬운 것이었는데도 이렇게 많은 실수를 하였다.
이런 실수들이 실험 Data에서 wt%와 몰분율을 계산한 결과에서 나타났다. 실험을 진행할수록 매회 아세톤의 wt%가 증가해야 하는데 7회에서부터는 감소하기 시작했다. 이것은 아세톤의 첨가량이 종말점을 오버해 버렸기 때문이다.
본 실험은 아세톤을 얼마씩 가하라는 지표가 없어서 오로지 실험자의 직감으로 아세톤을 가해야 하는 것이라 많은 실수가 있었다. 또한 상의 경계를 구별하는 것 역시 실험자를 난감하게 했다. 하지만 실험자가 좀 더 신중히 실험에 임했다면 그리 문제되지 않은 것이었다고 생각한다. 잘못된 실험으로 많은 오차를 갖게 되었고 Data에서도 많은 오차가 생겼다. 실험에 임할 때 신중히 해야겠고 사전지식도 충분히 갖추어야 겠다.
2. 다음 혼합물에 대하여 각 물질의 무게 퍼센트 및 몰분율을 계산하라.
1) 물 1.00 ㎖ + 톨루엔 9.00 ㎖ + 아세톤 19.50 ㎖
물의 wt% = (0.998×1)/{(0.998×1)+(0.866×9)+(0.792×19.5)}×100 = 4.1%
톨루엔 wt% = (0.866×9)/{(0.998×1)+(0.866×9)+(0.792×19.5)}×100 = 32.2%
아세톤 wt% = (0.792×19.5)/{(0.998×1)+(0.866×9)+(0.792×19.5)}×100 = 63.7%
물의 몰분율 = (0.998×1/18)/{(0.998×1/18)+(0.866×9/92)+(0.792×19.5/58)} = 0.14
톨루엔의 몰분율 = (0.866×9/92)/{(0.998×1/18)+(0.866×9/92)+(0.792×19.5/58)} = 0.21
아세톤의 몰분율 = (0.792×19.5/58)/{(0.998×1/18)+(0.866×9/92)+(0.792×19.5/58)} = 0.65
2) 물 9.00 ㎖ + 톨루엔 5.00 ㎖ + 아세톤 30.32 ㎖
물의 wt% = (0.998×9)/{(0.998×9)+(0.866×5)+(0.792×30.32)}×100 = 24.1%
톨루엔 wt% = (0.866×5)/{(0.998×9)+(0.866×5)+(0.792×30.32)}×100 = 11.6%
아세톤 wt% = (0.792×30.32)/{(0.998×9)+(0.866×5)+(0.792×30.32)}×100 = 64.3%
물의 몰분율 = (0.998×9/18)/{(0.998×9/18)+(0.866×5/92)+(0.792×30.32/58)} = 0.52
톨루엔의 몰분율 = (0.866×5/92)/{(0.998×9/18)+(0.866×5/92)+(0.792×30.32/58)} = 0.05
아세톤의 몰분율 = (0.792×30.32/58)/{(0.998×9/18)+(0.866×5/92)+(0.792×30.32/58)} = 0.43
나. 용해도 곡선상의 점들이 다음 조성을 갖는다. 용해도 곡선을 그려라.
용해도 곡선상의 점들의 조성 (WT%)
성분 번호 | A | B | C |
1 2 3 4 5 6 7 8 | 0 16 25 30 27 20 10 0 | 90 70 55 40 27 20 16 14 | 10 14 20 30 46 60 74 86 |
참고 문헌
1. 물리 화학 3판, Peter Atkins, p.99~106, OXFORD, 2001년
2. 물리화학 실험, 김경림, 자유아카데미, 1999년
3. 물리화학의 원리, 박병각 외저, p.170~173, p.222~225, 학문사, 1995년






!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글