화학에서 자연을 보는 관점은 거시적 (macroscopic) 관점과 미시적 (microscopic) 관점 두 가지가 있다.
거시적인 관점은 자연의 현상을 전체적으로 관찰하여 어떤 규칙을 발견하는 것이다. 보일의 법칙을 예를 들면 보일은 기체의 부피와 압력이 서로 반비례하는 규칙을 발견하였다.
반면에 미시적인 관점은 개별 분자의 입장에서 출발해서 규칙을 만들어내는 것이다. 예를 들면 기체분자가 탄성 운동을 하고 있다는 전제로부터 출발해서 분자의 운동에너지를 계산하여 보일의 법칙을 증명할 수 있다.
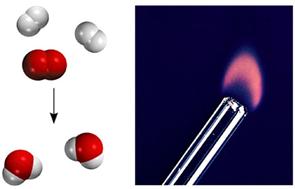 |
| 화학적 변화와 결합의 변화. 수소와 산소가 반응하여 물이 되는 반응에서 볼 수 있는 것처럼 화학적인 변화에서는 원자들 사이의 결합이 변한다. |
물리적 변화에서는 화학결합에 변화가 일어나지 않지만 화학적 변화에서는 화학결합이 변한다. 물이 고체 → 액체 → 기체로 바뀔 때 산소 하나에 수소 두 개가 결합한 구조는 변하지 않고 단지 상태만 변한 것을 볼 수 있다. 그러나 수소와 산소가 반응하여 물이 될 때는 그림에서 볼 수 있는 것처럼 결합이 변한 것을 볼 수 있다.
물리적인 변화에서는 그 물질의 고유한 성질이 그대로 보존되지만 화학적인 변화에서는 다른 물질로 바뀌기 때문에 다른 성질을 갖게 된다. 아래 그림에서는 수은과 요오드가 반응하여 전혀 다른 성질을 갖는 요오드화수은이 생성된 것을 볼 수 있다.
 |
화학적 변화의 예. 왼쪽 위에 있는 수은은 오른쪽 위에 있는 요오드와 반응하여 이 둘과 전혀 다른 성질을 갖는 요오드화수은을 만든다.
|
물리적 성질은 위에서 설명한 화학적인 변화가 없이 관측하거나 측정할 수 있는 성질이다. 색, 밀도, 녹는점, 끓는점, 전도도 등을 예로 들 수 있다. 이 물리적 성질은 다시 두 가지로 나눌 수 있는데 질량이나 부피처럼 양에 의존하는 성질은 크기성질 (extensive property) 이라고 하고 밀도, 녹는점, 끓는점과 같이 시료의 양에 의존하지 않는 성질은 세기성질 (intensive property)라고 한다.
화학적 성질은 화학적인 변화를 통해 나타난다. 어떤 물질이 잘 타는지 또는 녹이 잘 스는지 하는 것들은 화학적인 성질이다.


!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글