실험 목적
본 실험에서는 확산계수에 대해 알아본다. 확산계수가 왜 중요하며 언제 사용되는지 알아보고 stefan 확산 cell을 이용하여 ethanol, acetone, ethyl ether이 공기나 질소 중으로 증발할 때 확산계수를 측정한다. 또한 이 값들을 문헌값이나 각종 추산식에 의한 계산값과 비교한다. 실험한 값이 얼마나 정확한지 알아보고 어떤 외란에 의해서 좌우되는지 알아본다.
실험 이론 및 원리
확산이란, 혼합물 중에 상대적으로 휘발성이 큰 물질의 이동이 있는 것을 말한다. 확산이 일어나는 주된 원인은 확산되는 물질의 농도차이며, 이것은 거리에 따라 농도가 달라지게 되기 때문에 이를 농도 기울기라고 한다. 확산의 일반적인 원인은 농도 기울기에 있지만, 이밖에 압력 차에 의한 압력 기울기, 온도차에 의한 온도 기울기 또는 원심력과 같은 외부의 힘에 의해서 확산되기도 하는데, 이러한 확산을 압력확산, 열확산 및 강제확산이라고 한다.
예를 들면, 물과 접촉하고 있는 소금 결정은 물과 소금의 계면에서는 소금의 농도가 높고, 계면에서 멀어지면 소금의 농도가 낮아지는 것을 알 수 있다. 또, 암모니아수가 들어있는 암모니아수 병 뚜껑을 공기 중에 열어 두면, 그 주변에서는 암모니아수가 발생하여 냄새가 고약하나 멀리 떨어져 있는 곳에서는 냄새가 덜 나고, 시간이 지나면 거의 모든 곳에서 거의 같은 정도로 냄새를 맡을 수 있게 되는데, 이것이 바로 확산에 의한 현상이다.
기체 A가 기체B 속으로 확산하는 경우 성분 A의 확산 플럭스 JA [㏖/㎠·s]는 Fick의 제1법칙을 따른다.
 |
| (1) |
JA = 성분A의 확산 플럭스 (㏖/㎠·s) DAB = 확산계수 (㎠/s) | CA = 성분A의 몰농도 (㏖/㎤) Z = 확산거리 (㎝) |
한편, 난류가 일어나지 않는 유체상에서 A성분의 이동속도 NA는 다음과 같다.
 |
| (2) |
NA = 성분 A의 이동속도 (㏖/㎠·s) NB = 성분 B의 이동속도 (㏖/㎠·s) | ρM = 혼합물의 몰밀도 (㏖/㎤) |
| (3) |
CA,CB = 성분 A,B의 몰농도 (㏖/㎤) P = 전압 (atm) | R = 기체상수(㎤·atm/㏖ K) T = 절대온도 (K) |
식 (2)를 변형하면 식 (4)가 얻어진다.
 |
| (4) |
 |
| 그림 1 확산 cell |
그림 1에 나타낸 바와 같이 확산 cell의 수직관 밑에 성분 A의 액체를 넣고 상부의 수평관 내에 성분 B의 기체를 흐르게 하면, 액면에서 증발한 성분 A의 증기는 수지관내의 기체 B중을 확산하여 관 상단에 이르고 기체 B와 같이 계외로 배출된다. 이때 관 상단에서 성분 A의 농도가 zero가 되도록 기체 B를 충분이 흘려 보낸다. 수직관내의 액체 A의 증발은 액체 A에 기체 B가 녹지 않는다면 일방확산이다. 그러므로
NB = 0 --------------------- (5)
식 (3)과 식 (5)를 식 (4)에 대입한 후 적분하면
 |
| (6) |
yA = 기상중 성분 A의 몰분율 | yAi = 기액 계면에서 성분 A의 몰분율 |
식 (6)을 변형하면
 |
| (7) |
PA = 기상중 성분 A의 분압 (atm) | PAi = 기액계면에서 성분 A의 분압 (atm) |
시간 t에서 액면의 위치를 Z라고 하면 성분 A의 물질이동속도 NA는
 |
| (8) |
ρχ = 성분 A의 액체 밀도 (g/㎤) | MA = 성분 A의 분자량 |
수직관내 초기 액면과 관상단과의 거리를 Z0, t시간 후의 액면과 관상단과의 거리를 Zt라고 하고 식(8)을 시간 t에 대해 적분하면 다음 식과 같다
 |
| (9) |
식 (9)를 변형하면
| (10) |
단,
시간 t와 Z와의 관계를 실측하고 (Zt-Z0)와 t/(Zt+Z0)를 도시하면 직선이 얻어지며 이 직선의 기울기로부터 확산계수 DAB를 구할 수 있다.
한편, 기체의 확산계수를 예측하는 식은 여러 가지가 있으며 그중 기체분자 운동론으로 부터 얻어진 Chapman-Enskog식이 많이 이용된다.
 |
| (11) |
DAB = 확산계수 (㎠/s) MA,MB = 성분 A,B의 분자량 T = 절대온도 (K) P = 압력 (atm) | σAB = 유효충돌직경(Å) ΩD = 충돌적분 f(КT/εAB) К = Baltzman상수[erg/K] |
2. Psuedo steady-state diffusion (의사정상상태 확산)
대부분의 물질전달 공정에서 시간이 경과함에 따라 경계(boundary)의 한가지는 변화할 수도 있다. 확산경로의 길이가 오랜 시간의 경과로 약간 변화한다면 의사정상상태 확산모델이 사용된다. 이 조건으로 (12)식은 정체 기체 경막에서 물질플럭스를 나타낸다.
확산 cell상에서, 시간 t0와 t1 에서의 두 개의 표면높이가 있다. 시간경과에 따른 액체 A의 높이의 차가 전체 확산경로의 아주 적은 부분을 차지하고, t1-t0가 비교적 긴 시간간격이라고 하면 주어진 시간범위에서 기체상에서의 몰플럭스는 다음과 같다.
 |
| (12) |
여기서 Z2-Z1은 시간 t에서 확산경로의 길이 Z와 같다.
액체를 떠나는 A의 양에 관계되는 몰플럭스 NA,Z는
 |
| (13) |
이고, 여기서 ρA,L/MA는 액체상의 A의 몰밀도(㏖ar density)이다.
의사정상상태에서 (12)식과 (13)식은 결합하여,
 |
| (14) |
이된다.
(14)식을 t=0에서 t=t까지 Z=Zt0 에서 Z=Zt까지로 적분해 주면,
가 구해진다. 이것을 재정리해 보면 Arnold 셀 실험장치의 데이터로부터 얻은 기체확산계수를 계산하는 데 일반적으로 사용하는 식을 얻게 된다.
이 식은
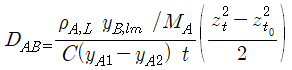 |
| (17) |
실험 기구 및 시약
1. 실험 장치
T자형 확산 cell을 manometer, 질소 또는 공기공급원과 연결하고 항온조에 넣어 일정 온도로 유지되게 한다. 공기를 이용할 경우에는 aspirator를 사용하는 것이 간편하다. 액의 높이는 cathetometer로 읽는다.
실험 방법
1. 실험 과정
1) 항온수조의 온도를 미리 일정하게(20, 25, 30, 35℃) 고정한다.
2) 확산 cell에 확산거리가 약 10㎝정도 되도록 ethanol, acetone, ethyl ether 중 한 성분을 넣고 그림과 같이 연결한다.
3) 확산 cell 부분이 수직이 되도록 지지대로 항온수조에 고정한다.
4) 확산 cell에 공기나 질소를 흐르게 한다.
5) 기체를 흐르게 하여 약 15분 후를 t=0으로 하고 이때의 액체의 위치를 읽어 Z0로 한다.
6) 약 10-15분 간격으로 액체의 위치를 읽는다. 실험은 약 2시간 동안 행한다.
7) 다른 온도에서 위의 실험을 반복한다.
실험 결과
1. 결과 분석
1) 실험결과를 표로 작성한다.
2) (Zt-Z0)와 t/(Zt+Z0)를 plot하여 얻어진 직선의 기울기로 부터 확산계수를 구한다
3) 직접 실험결과를 대입하여 확산계수를 구한다.
먼저 PAi값을 다음의 Antoine식을 이용하여 구한다.
lnPAi = A - |
|
PAi:kPa, T:℃
아세톤에 대하여 Antoine 식의 상수는
A=14.3916, B=2795.82, C=230.00
lnPAi = 14.3916 - |
| = 5.01 |
PAi = e5.01 = 149.9kPa = 1.479atm
ρx = 0.7844g/㎤, R=82.057㎤·atn/㏖·K, T=341.15K
P=1atm, PA=0, PAi=1.479atm, MA=58.08
Z0=6.135㎝, Zt=6.136㎝, t=6000sec
증기압이 P보다 크므로 값이 안나온다. 윗 antonie식은 화공열역학 데이터를 이용한 것으로 다른 자료를 이용하여야 할 것이다.
4) 실험온도와 압력에서 확산계수를 계산한다.
σAB = |
| = 4.1555 |
| = |
| = 1.626 |
ΩD = 1.160
DAB = |
| = 0.1329㎠/s | |||||||||||
실험값과 추산식에 의한 계산값 및 문헌값을 비교하여보면 표준온도와 압력하에서,
DAB = 0.32ft2/h = 0.08259㎠/s
341.15K, 1atm에서
DAB ≅ 0.08259×( |
| )1.75 = 0.122㎠/s |
실험 겉으로 보기에는 쉬워 보였으나 막상 쉬운 작업은 아니었다 확산에 대해 아는것과 그래프 기울기를 통해 확산계수 구하는 것은 까다로운 작업이었다. 또 렌즈를 통한 눈금 정확히 관찰하는데 애를 먹었다. 눈금의 단위를 정확히 파악하지 못한체 무작정 읽어려는게 잘못 이었다. 나중에 다시 방법을 배우게 되어, 제대로 관찰할수 있게 되었다. 항온조가 온도가 변하지 않아야 되는데 변해 오차범위가 나타난 것 같다.
참고 문헌
1. 단위조작, 이화영,전해수,조영일 공역, p.530-514, 부록 18, 19












!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글