실험 목적
1. Bacteria 들을 액체 배지 혹은 고체 배지에서 배양하는 방법을 배울 수 있고, 또 이것들을 배양 과정에서 어떻게 보관해야하는지 알아본다.
2. 이렇게 배양된 cell 들의 수를 count하는 방법을 배우며, 이들이 시간에 따라 어떤 성장곡선을 그리는지 알아 볼 수 있다.
실험 이론 및 원리
cell을 키우는 방법에는 고체 배지에서 키우는 방법과 액체 배지에서 키우는 것, 두 가지 방법이 있다. 고체 배지에서 키우는 이유 는 single colony를 얻기 쉽게 하기 위해서이고, 액체 배지에서 키우는 이유는 cell mass를 쉽게 많이 얻기 위해서이다. E.Coli등 많 은 미생물의 경우 이분법 분열로 증식하는데, 하나의 cell로부터 증식한 개체는 모두 같은 유전정보를 갖게 되고, 그들이 한데 뭉쳐서 colony를 이루게 된다. 따라서 하나의 cell로부터 나온 colony를 single colony라고 하여 그들을 얻으면 이후의 실험에서 형 질 차이를 극복할 수 있다. 고체 배지에서 single colony를 얻는 streaking 방법과 액체 배지를 희석시켜서 single colony를 얻는 spreading 방법의 두 가지가 주가 된다.
2. Growth Curve
시간이 흐름에 따라서 세포의 양을 그래프로 그려놓은 것이 Growth Curve이다. Bacteria에게 충분한 영양을 공급해주면 시간이 지나면서 분열을 거듭하여 다음과 같은 Curve를 나타낸다.
 |
| 그래프의 x축은 시간이고, y축은 세포의 양을 log값으로 나타냈다. |
Growth Curve는 네 가지 state로 나뉜다.
ⓐ Lag Phase : 미생물 집단을 새로운 배지에 접종하면 생장이 시작될 때까지의 state로 환경에 적응하는 기간이다. 조효소 등 왕성한 생장에 필수적인 생체물질의 세포내 농도가 일정한 농도가 되도록 합성하는데 걸리는 시간이 필요하기 때문에 존재한다.
ⓑ Exponential Phase : 실제로 분열하며 생장하는 시기로 이분법으로 분열을 하기에 으로 세포수가 증가한다. E.Coli의 경우 보통 doubling time이 20분이다.
ⓒ Stationary Phase : 배지의 필수 영양소가 완전히 소비되거나 미생물이 자라면서 생기는 폐기물의 양이 축적되면 집단 내에서 어떤 세포는 자라는 대신 다른 세포는 죽기 때문에 마치 정지한 것처럼 보인다.
ⓓ Death Phase : Stationary Phase에서 계속 배양하면 세포 총 수는 유지되지만 살아있는 세포 수는 점차 감소한다. 이러한 경우 Spectrophotometer로 세포 수를 측정할 수 없기 때문에 CFU(Cell Forming Unit)를 이용한다.
3. Cell Counting
세포의 수는 적은 volume에도 매우 많은 수로 존재하여 일일이 그 개수를 세기가 힘들다. 따라서 대략적인 세포의 수를 측정하는 척도로 OD(Optical Density)를 이용한다. OD를 측정하는 데 쓰는 기기가 Spectrophotometer 이다.
이 기기에다 작은 아크릴큐벳에 세포가 들어있는 액체를 넣고(보통 1㎖) 한 쪽 면에서 일정한 파장의 빛을 쏘아주고 그 맞은 편에 도달하는 빛의 양을 측정하 게 된다. 분사광과 투과광의 차이를 계산한 값을 OD라고 하고 이것이 세포가 흡수한 빛의 양이므로 이를 세포의 수를 세는 척도 로 이용할 수 있다. 그러나 살아있는 세포와 죽은 세포의 수를 모두 헤아리기 때문에 실제 생장하는 세포의 수를 구하기 위해서는 다른 방법을 사용한다.
CFU(Cell Forming Unit)은 균집락형성능을 의미하며 1㎖당 존재하는 미생물 수를 나타낸다. 이것은 세포 하나가 single colony를 형성하도록 하여 그 수를 측정하는 방법이다. 쉬운 counting을 위하여 희석 후 적은 샘플을 통해 측정하게 된다.
실험 방법
① 액체배지 10㎖를 auto pipet을 이용해 tube에 넣고 cell seed를 100㎕ 첨가한다. Cell을 샘플링 할 때는 pipetting을 통해 잘 섞어준다.
② spectrophotometer에 들어가게 되는 큐벳에 증류수 1㎖를 옮겨 담은 후, 이것의 OD를 측정하여 일종의 기준값인 Blank로 삼는다. 모든 빛이 여과 없이 통과했을 때의 빛의 양을 알아야 cell에 의해서 흡수된 후의 빛의 양과 비교해서 그 OD값을 알 수 있기 때문이다. 큐벳을 3차 증류수와 휴지를 사용해 깨끗이 닦는다. 특히 옆면에 물기나 먼지가 묻어 있으면 빛 투과 시 오차가 발생하 므로 물기와 불순물을 깨끗이 닦아야 한다.
③ 위 tube에서 1㎖를 따 큐벳에 넣은 후 OD값을 측정한다. 남는 액체 배지 용액 tube는 shaking incubator에 넣어 배양을 한다, 이때 Test tube를 사선으로 뉘어서 넣도록 한다. 공기와 접촉면을 넓게 하여 산소를 더욱 충분히 공급해 주기 위해서이다. 그리고 20분에 한번 씩 꺼내 OD를 측정을 반복한다. 그래프로 나타내면 성장 곡선이 된다.
➃ CFU측정을 위하여 세균이 자라있는 용액으로 serial dilution을 통해 1/100 과 1/1000로 희석된 샘플을 만든다. 그 과정과 비율은 다음 그림과 같다.
희석 후 1/100 과 1/1000 각 용액에서 100㎕씩 plate에 loading을 한다. 전체적으로 분포시키기 위하여 100% 알코올에 담가둔 spreader를 꺼내 화염멸균을 하고 페트리 디쉬의 뚜껑에 대어 식힌 후 골고루 문지른다. 이때 1/1000을 먼저 작업 후 1/100을 해 야만 결과에 영향이 없다. 배양시킨 후 colony의 개수를 센다.
2. 고체배지에서 single colony isolation
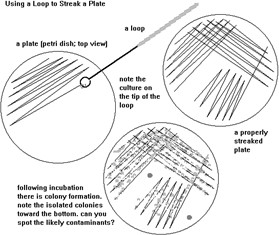
① 멸균된 백금선 loop로 배지에 균을 streaking 하게 된다. 각 선을 새로 그을 때마다 루프를 소독을 해주어야 한다. 불에 빨갛게 달구어 소독을 하는데, 이때에는 루프 전체를 멸균하지 않고, 앞의 철사 부분 정도만 소독해주어도 된다. 역시 식혀줄 때에는 잘 사용하지 않는 배지의 가장자리 부분에 갖다 대어 식혀주도록 한다. 37℃ incubator에서 하루간 배양시키면 colony가 나타나게 된다.
② Streaking을 위해 사용하는 방법은 삼분도말법이다. 자세한 방법은 다음과 같다. 첫 번째 선은 작은 범위로 10회 정도 그어주 고, 두 번 째 선은 5번 정도 첫 번째 선과 겹치게 왕복하여 그려주다가 나머지 5번 정도 겹치지 않게 선을 그려준다. 마지막 세 번 째 선은 두 번째 선과 두 서너번 겹쳐서 그리다가, 나머지 선이 그려지지 않은 배지 표면 전체를 왕복하여 선을 그려 주도록 한다.
 |
Isolating single colonies by spreading liquid aliqiots of cell culture. |
실험 결과
|
측정된 결과는 이와 같다. 시간에 따른 OD 값을 log scale로 그렸다. 측정값이 계속 증가하다 마지막에는 감소하였다. 초기에 급 속한 성장을 하다가 마지막에는 감소한 것처럼 보인다. 하지만 OD 값은 죽은 세포도 측정하기에 낮아지는 이유가 의문점이다.
2. CFU 측정 및 streaking 사진
위쪽이 streaking한 사진이며 아래가 CFU를 구하기 위해 spreading한 사진이다. 우선 streaking에서는 single colony가 넓게 퍼지 지 못하고 뭉쳐있으며 삼분도말법 가운데 두 번째 단계에서 끝이 난 것을 볼 수 있다. Spreading을 한 배지는 colony로 뒤덮여 도 저히 개수를 헤아릴 수 없게 되었다.
토의 사항
① 미숙한 조작으로 인해 streaking을 제대로 하지 못하여 plate에 cell이 제대로 퍼지지 못하였다. 경험이 필요한 작업인 만큼 손 기술은 많은 실험을 통해 익숙해져야 한다. 허나 균이 죽어서 나타나지 않았을 경우도 있다. 도말을 할 때 백금을 사용하는 이유 는 빨리 데워지고 빨리 식어 살균에 효과적이기 때문이다. 그러나 제대로 식히지 않을 경우 세포가 타게 되어 사멸하고 만다.
② 배지보다 밀도가 높은 세균은 주로 아래에 가라앉아 있기에 시험관 아랫부분과 윗부분의 농도차이가 심하다. 매번 샘플을 취 할 때 pipetting 과정을 거치긴 하였으나 같은 시간대에 여러번 OD를 측정 결과 차이가 많이 났다. 아마도 용액에서 샘플을 얻는 이 과정에서 오차가 많이 날 것이다.
③ OD값은 spectrophotometer를 사용하여 측정하는데, 이것의 원리는 빛을 쏘아주어 용액이 담긴 tube를 통과한 후 빛의 양과 처음 쏘아줄 때의 빛의 양의 차이, 즉 흡광도를 분석하여 용액에 담긴 세포의 개수를 측정하는 것이다. 이때, 흡광도는 Lambert- Beer의 법칙에 따라 세포의 농도와 비례하게 된다. 용액 내에 세포가 너무 많게 되면, 쏘아준 빛이 굴절하여 제대로 투과를 하지 못하게 되어 오차가 너무 커지게 된다. 따라서 spectrophotometer로 측정을 하기 전에 미리 용액을 희석해 놓아야 한다. 이번 실험에서는 그대로 사용하였기 때문에 OD값 측정에 문제가 있을 가능성이 있다.
➃ OD 측정시 주로 파장이 600㎚의 빛을 사용한다고 한다. 왜냐하면 세포가 가지고 있는 아미노산 중에 분자 구조 내에 ring을 가지고 있는 tyrosin, histidine 등의 아미노산이 600㎚의 빛을 흡수하므로, 이 빛을 이용해 cell의 수를 세야하기 때문이다. 만약 세포가 죽으면 세포내 아미노산 구조를 유지할 수 없어 흡광도가 살아있는 세포보다 낮을 수 있다. 그렇다면 실험 결과에서 값이 떨어진 이유를 설명 할 수 있다. 죽은 세포의 흡광도가 낮다고 가정할 때 군집이 이미 stationary phase를 넘어 death phase로 가 고 있다면 OD가 낮아질 수 있게 된다. 이렇게 빨리 대장균이 사멸하게 되는 이유로는 불충분한 배지 혹은 좁은 공간 등이 있을 것이다.






!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글