실험 목적
용액에서 용질의 몰랄부피는 분자의 상태와 구조는 물론 용질과 용질, 용질과 용매, 그리고 용매와 용매 분자간의 상호작용에 대한 유용한 정보를 나타내고 있다.
무한 희석시와 진한 농도에서 각각 용질-용매,용매간의 상호작용에 대한 정보와 용질-용질간의 정보를 얻을 수 있다. 또한 공학 및 해양과학에서 이온평형과 압력을 산출하는데 이용되기도 한다.
본 실험에서는 조성(무게%로 나타낸 것)을 미리 알고 있는여러 NaCl-H2O 용액들 중에서의 물과 소금의 분몰랄 부피를 결정하는 데 있다.
실험 이론 및 원리
1. 분몰랄 부피
열역학적 평형에 도달한 용액상은 압력(P), 온도(T), 부피(V), 내부에 너지(U), 엔트로피(S), Gibbs free energy(G), enthalpy(H)와 같은 상 태함수로 표현이 가능하며, 이러한 함수들은 용액의 조성에 의존하게 된다. 일반적인 2성분계에서 서로 다른 성분사이에 상이한 상호작용을 하지 않는 이상용액을 이룬다면 용액의 성질은 각 성분의 몰 비에 대한 합산량에 따라 결정되게 된다. 그러나 대부분의 용액은 분자간 상호작 용을 하게되며, 그 상호작용으로부터 비이상성을 나타내게 된다. 일정한 온도 및 압력하의 2성분 용액을 생각해 보자. 용액이 성분 A 를 nA몰, 성분 B를 nB몰 포함하고 있을 때, 각 성분의 몰수에 관한 그 상의 V,S,G 등의 편미분량을 일반적으로 분몰랄량이라고 부른다.
이 용액의 크기성질(Y)은 어느 것이든지 다음 식으로 나타낼 수 있다.
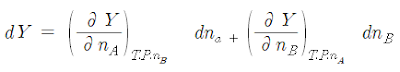 |
| (1) |
분몰랄양을 다음과 같이 정의하면
 |
| (T와 P는 상수) |
(1)식은
 |
| (2) |
위식이되고, (2)식을 적분하면
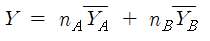 |
| (3) |
위 식이 된다.
겉보기 몰랄부피(ΦV)를 다음과 같이 정의하면 유용하다.
 |
| (4) |
여기에서 V는 A물질 nA몰과 B 물질 nB몰을 함유하고 있는 용액의 전체 부피이고, Ao은 주어진 온도와 압력에서 순수한 A(용매) 1몰의 부피이다. 식(4)를 정리하면
| (5) |
가 되며, 이 식을 nB에 대해서 미분하면 식 (6)이 된다.
 |
| (6) |
식 (3)의 YB, YA, Y 대신에 VB, VA, V를 대입하고 VA에 대해 풀면 다음 식을 얻는다.
 |
| (7) |
식 (5), (6), (7) 로부터
 |
| (8) |
를 얻는다.
만일 ΦV를 nA, nB 두 물질 A와 B의 이미 알고 있는 분자량 (MA, MB) 및 실험으로 결정한 용액의 밀도(ρ)로써 나타낼 수 있다면 식 (6)과 (8)로부터 용액의 농도가 nA및 nB로 주어질 때 이에 해당하는 A 및 B를 계산할 수 있다.
이렇게 하기 위하여 우선 V = (nAMA+nBMB)/ρ를 식(4)에 대입하여 ΦV를 구한다.
 |
| (9) |
농도를 몰랄농도(m)로 바꾸기 위해서 nB ⇒ m, nA ⇒ 1000/MA로두면 식 (9)는
 |
| (10) |
이 된다. 그런데 MA/Ao = ρAo 즉 주어진 온도와 압력에서의 순수한 A의 밀도이므로
 |
| (11) |
가 된다.
실험으로 얻은 결과를 ΦV, vS. m½ 의 그래프를 그려 나타낸다. 각 점을 지나는 가장 잘 맞는 직선을 그리고, 이 직선의 기울기와 절편을 결정한다. 이 직선의 기울기를 2m½ 로 나누어 식 (6)과 (8)에 나오는 편미분을 구한다. 그래프의 직선의 기울기는 (∂φV/∂m½)T,P,nA이지만 다음 관계식도 성립하게 된다.
(∂φV/∂nB)T,P,nA = 1/2m½(∂φV/∂m½)T,P,nA (12)
그래프로부터 기울기를 구한 후 식 (6)과 (8)을 이용하여 A 및 B를 계산할 수 있다. 그래프는 전자계산 프로그램을 이용하여 구한다.
※ 겉보기 부피와 실제부피의 차이
- 겉보기 부피 : 물질의 실제부피가 아닌 실험으로 보이는 부피.
2. 다른 분몰량
분몰 함수를 분몰 함수를 분몰 부피로서 예를 들어서 설명하였지만 이와 마찬가지 식이 다른 모든 분물함수에도 적용될 수 있다. 분몰 Gibbs함수는 화학 퍼텐셜이다. 즉,
μA = (∂G/∂nA)T,P,nB
분몰 엔탈피는 다음과 같다.
HA = (∂H/∂nA)T,P,nA
HA와 HB는 성분들이 섞이어 용액이 될 때의 엔탈피 변화를 계산하는 데 사용된다. 즉, A와 B의 용액에서는 다음이 주어진다.
ΔH(용액) = H(용액) - H(성분)
ΔH(용액) = nAHA + nBHB – nAHA˚ - nBHB˚ = nA(HA-HA˚) + nB(HB-HB˚)
모든 열역학적 관계식은 분몰 함수에도 적용될 수가 있다. 예컨대,
3. 기타 다른 농도 정의
1) 백분율 농도
백분율 농도에는 다음과 같은 농도가 있다.
① v/v %농도 : 용질부피 / 용액부피 × 100 [ℓ/ℓ] → vol % 표시
② w/w %농도 : 용질무게 / 용액무게 × 100 [g/g] → wt % 표시
통상 %농도라 하면 주로 w/w%를 의미한다.
밀도가 1g/ℓ경우 동일한 계산결과가 나옴.
일반적인 물의 밀도 = 1 ㎎/㎤ = 1 g/㎖ = 1 ㎏/ℓ
w/w %농도는 무게백분율이라 부르며, v/v %농도는 부피백분율이라고 칭한다.
무게 (weight) : 물체에 작용하는 중력의 크기, 중량이라고도 한다.
질량 (mass) : 물체의 역학적 성질을 결정하는 물체 고유의 기본적인 양
2) ppm 농도 [parts per million]
ppm 농도는 어떠한 용질 1㎎이 용액 1,000,000 ㎎ (즉 1 ㎏)중에 들어있는 농도를 말한다. (단 비중 이 1인 경우)
x ppm 농도의 용액을 만들 경우 용질무게 x ㎎에다, 용질무게를 포함한 용액전체의 무게가 1 ㎏ (=1,000,000 ㎎)이 되도록 용매를 넣어주어야 한다.
미량분석의 정량범위, 검출한계 등을 수적으로 표현하는 단위로 ppm 농도와 %농도간의 환산문제을 자주 실시하며, %는 백분율이므로 1/100이 1%가 된다. ppm은 백만분율이므로 1/1,000,000의 값이 1 ppm이 된다.
따라서 1 = 100% = 1,000,000 ppm 이며, 1% = 10,000 ppm 이다. 그러므로 % 농도를 ppm 단위로 고치려면 10,000 ppm/%를 곱해주어야 한다.
x ppm 농도 = w/w %농도 × 10,000 [ppm/%]
3) ppb 농도 [parts per billion]
수질오염도나 대기오염도를 나타내는 단위로 ppm 농도와 ppb 농도간의 환산문제을 자주 실시하며, 일반적으로 ppb 농도를 1,000으로 나누면 ppm 단위의 농도가 된다.
단순히 ppb은 1/109 을 표현함.
x ppm 농도 = ppb 농도 × [1 ppm/1000p]
4) 몰농도 (molarity : M)
용액 1ℓ에 들어 있는 용질의 몰수를 말하며, M 또는 g-㏖/ℓ로 나타낸다.
M = (w/Mw) × (1,000/V)
w : 용질의 무게(g), Mw : 용질의 분자량(g/g-㏖), V : 용액의 부피(㎖)
M = (10×w/w %농도×ρ)/Mw
Mw : 용질의 분자량(g/g-㏖), ρ : 용액의 밀도(g/㎖)
5) 몰랄농도 (molality : m)
용매 1 ㎏ 중에 용해되어 있는 용질의 몰수(g-㏖수), m으로 표시한다. 단위는 [g-㏖/㎏], 주로 라울의 법칙이나 삼투압 측정 등에 이용된다.
몰랄농도(molality) = 용질의 g-㏖수 / 용매 1 ㎏
몰랄농도(molality) = (w / Mw) / (S / 1000)
w : 용질의 무게(g), Mw : 용질의 분자량(g/g-㏖), S : 용매의 무게(g)
6) 노르말농도 (Normal : N)
용액 1ℓ속에 녹아 있는 용질의 g-당량수로 나타내며, N으로 표시한다.
노르말농도 (N) = 용질 g-당량수/용액의 부피(ℓ)
노르말농도 (N) = (w/E) × (1000 / V)
w : 용질의 무게(g), E : 용질 1g 당량수(g/g-당량), V : 용액의 부피(㎖)
g 당량수 = 분자량 / (1분자중의 H+ 또는 OH- 수)
7) 몰분율 (molar fraction)
어떤 성분의 몰수(數)와 전체 성분의 몰수와의 비를 말한다. 1,2,3,...i 성분이 각각 n1, n2, n3,...ni 몰씩 섞여진 혼합물로 구성되어 있다고 하면 혼합물의 총 몰수는
N = n1 + n2 + n3 + ......ni
i 성분의 몰분율은 Xi = ni/N이고, 각 성분의 몰분율을 모두 합하면 1이 된다.
즉, X1 + X2 + X3 + ....Xi = n1/N + n2/N + n3/N + .....ni/N = (1/N)(n1 + n2 + n3 + ... + ni) = N/N = 1 으로 계산이 되어진다.
4. 관련 물리상수
1) 관련 물리 상수
℃ | Specific gravity of air at various temperatures | Water |
spGr×104 | Density g/㎖ | |
25 | 11.843 | 0.997070 |
26 | 11.803 | 0.99681 |
27 | 11.764 | 0.99654 |
28 | 11.725 | 0.99626 |
29 | 11.686 | 0.99597 |
30 | 11.647 | 0.99567 |
31 | 11.609 | 0.99537 |
32 | 11.570 | 0.99505 |
33 | 11.533 | 0.99473 |
34 | 11.495 | 0.99440 |
Specific gravity of aqueous solutions | |||
%by weight | NaCl 20/4℃ | %by weight | NaCl 20/4℃ |
1 | 1.00053 | 10 | 1.0707 |
2 | 1.0125 | 12 | 1.0857 |
4 | 1.0268 | 14 | 1.1009 |
6 | 1.0413 | 16 | 1.1162 |
8 | 1.0559 | 18 | 1.1265 |
물의 밀도(20℃) | 0.998604(g/㎖) | NaCl의 분자량 | 58.44(g/㏖) |
공기의 밀도(25℃) | 0.001184(g/㎖) | ||
공기의 밀도(30℃) | 0.0011647(g/㎖) | H2O의 분자량 | 18.016(g/㏖) |
공기의 밀도(20℃) | 0.0011959(g/㎖) |
20℃에서의 자료(CRC, Handbook of Physics and Chemistry)
2) 20℃에서의 자료
용액번호 | ρs 용액의 밀도 | NaCl의 무게(%) | C(g㏖/L) |
1 | 1.117 | 16.00 | 3.056 |
2 | 1.087 | 12.00 | 2.229 |
3 | 1.057 | 8.00 | 1.445 |
4 | 1.028 | 4.00 | 0.703 |
5 | 1.012 | 2.00 | 0.346 |
실험 기구 및 시약
1. 실험 기구
1) 유리마개나 플라스틱 마개가 달려있는 25㎖ 짜리 용량 플라스크 2개(비중 병)
2) 항온조 100㎖, 비이커 2개, 메디슨 드롭퍼가 부착된 모세관피펫 2개
3) Kimwipes 또는 Kleenex 휴지, 천평, 염화나트륨, 증류수
4) 부피 플라스크(Volumetric Flask)
부피 플라스크는 플라스크의 목에 표시된 표선(mask)의 중심과 메니스커스의 밑바닥이 일치할 때, 20℃에 있는 특정 부피의 물이 담기도록 눈금이 매겨져 있다.(그림 1 및 표 참조) 대부분의 플라스크는 TC 20℃라고 표시되어 있는데, 이것은 20℃에서 표시된 부피를 담도록(To Contain) 눈금이 매겨져 있다는 것을 의미한다. 다른 종류의 유리기구는 그들의 표시된 부피를 옮기도록(To Deliver, "TD") 눈금이 매겨져 있다. 용기와 저장용기의온도는 액체와 유리가 둘 다 가열되면 팽창하기 때문에 중요하다.
플라스크용량(㎖) | 허용오차 (㎖) | 플라스크용량(㎖) | 허용오차(㎖) |
1 | ±0.02 | 100 | ±0.08 |
2 | ±0.02 | 200 | ±0.10 |
5 | ±0.02 | 250 | ±0.12 |
10 | ±0.02 | 500 | ±0.20 |
25 | ±0.03 | 1000 | ±0.30 |
50 | ±0.05 | 2000 | ±0.50 |
Table 1 A급 플라스크의 허용 오차
A급 유리제 부피 플라스크는 Table 1 에 나타낸 허용오차와 일치한다. 미량부석(ppb 농도)용 B급 폴리프로필렌 플라스틱제 플라스크는 분식물질이 유리벽에 흡착되어(달라붙는) 손실되거나 사용전에 흡착된 화학종에 오염될 가능성이 있을 경우에 사용한다. B급 플라스크는 표에 나타낸 허용오차의 두배 정도로 A급 플라스크보다 정확하지 못하다. 테프론이 입혀진 나사형 뚜껑이 있는 목이 짧은 플라스크는 분석 저울용으로 적당하다. 테프론은 용액이 뚜껑의 내부를 부식하는 것을 막아준다.
부피 플라스크는 기지 부피의 용액을 만드는 데 사용된다. 일반적으로 시약의 무게를 달아 부피 플라스크에 넣고 녹인 다음, 눈금까지 묽힌다. 그러므로, 시약의 질량과 요액의 최종 부피를 모두 알고 있다. 시약은 먼저 플라스크에 표시된 담는 양보다 적은 양의 액체로 녹인다. 그리고 액체를 더 가하고 용액을 다시 섞는다.
최종 부피를 맞추는 것은 가능한 한 플라스크 속에 있는 액체를 충분히 잘 혼합시킨 다음 해야 한다.(두가지 다른 액체가 혼합될 경우에는 일반적으로 약간의 부피 변화가 일어난다. 전체 부피는 반드시 혼합된 두 액체 부피의 합과 같지 않다. 액체가 플라스크의 가는 목에 도달하기 전에 부피 플라스크를 거의 채운 액체를 흔들어 줌으로써, 마지막 액체를 가할 때 일어나는 부피의 변화를 최소한으로 줄일 수 있다.) 액체의 마지막 방울은 분출병(Squirt bottle)이 아닌 피펫을 가하는 것이 최선의 방법이다. 용액을 최종 부피까지 정확하게 맞춘 다음 마개를 꼭 닫고 용액이 완전히 섞이도록 플라스크를 20회 정도 거꾸로 뒤집어야만 한다.
figure 1. 부피 플라스크. |
figure 2. 메니스커스. |
figure 2는 액체의 메니스커스가 부피 플라스크나 피펫 표선의 중심(Center)에 있을 때 액체가 나타내는 모양을 보여주고 있다. 액체의 높이는 표선의 아래위로 플라스크를 보면서 조절해야 한다. 메니스커스가 중심과 맞닿을때 표선의 앞과 뒤쪽은 타원형을 이룰 것이다. 적당한 메니스커스의 위치는 위 또는 아래에서 볼 때 메니스커스의 밑바닥은 매 겨진 표선의 앞과 뒤에 의해서 만들어지는 타원의 중심에 있다.
부피 플라스크와 Transfer Pipet은 이 위치에 눈금이 매겨져 있다. 유리는 미량의 화학약품, 특히 양이온들을 흡착한다는 것은 잘 알려진 사실이다. 흡착(Adsorption)은 표면에 달라붙는 다는 것을 의미 한다.(반대로, 흡수(Absorption)는 스폰지가 물을 흡수하는 것과 마찬가 지로 내부에 침투되는 것을 뜻한다.) 정밀한 실험을 위해서는 산 씻기 (Acid Washing)로 유리표면에 있는 낮은 농도의 양이온을 H+으로 치환시켜야 한다. 이러게 하기 위해서는 미리 충분히 잘 씻은 유리 용기를 약 1시간 동안 3~6M HCl 용액 속에 담그어 둔 다음 (후드 속에서), 증류수로 여러 번 헹구고, 마지막으로 증류수에 담 그어 둔다.
만약, HCl 용액을 유리 용기를 담그는 데만 사용하였다 면 그 후 몇 번 다시 사용할 수 있다. 이 실험에서 부피 플라스크 의 용도는 NaCl용액을 만드는데 있다. 사용 전에 부피 플라스크는 세제로 씻고 잘 헹구어 주어야 한다. 건조시킬 필요는 거의 없고, 필요하다면, 플라스크를 거꾸로 잡고 진공장치에 연결된 유리관을 플라스크 내부에 넣고 빨아내어 빠르게 건조시킨다.
부피 플라스크 속에서 직접 무게를 다는 법은 무게 차이에 의해 용질의 무게를 측정하는 것이다. 먼저 깔대기를 이용하여 정확하고 정량적으로 옮긴 뒤, 깔대기 전체를 씻고, 씻은 액을 플라스크에 모은다. 이때 만약에 용질을 녹이기 위해 열을 가해야 한다면 이 과정은 부적당하다. 앞서도 말했듯이 부피 플라스크는 20℃에 있는 특정 부피의 물이 담기도록 눈금이 매겨져 있기 때문이다. 용질을 녹이기 위해 열을 가해야 한다면 고체를 비이커나 플라스크에 넣어 무게를 달고, 용매를 가하고, 열을 가하여 용질을 용해시키고, 실온으로 식힌다음 이 용액을 정량적으로 부피 플라스크에 옮기면 된다.








!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글