단백질의 구조

1. 1차구조
Polypeptide의 아미노산 배열순서와 disulfide 결합 등의 공유결합 위치를 나타낸 구조를 말한다. 그림 1에 난백 lysozyme의 1차구조를 모식적으로 나타내었다. Lysozyme 분자는 129개의 아미노산으로 된 단쇄 polypeptide로 4곳에서 disulfide 결합을 하고 있으며 N 말단은 lysine이고 C 말단은 leucine이다. 단백질의 1차구조는 단백질의 정확한 분자량 결정하고 2차, 3차, 4차구조를 고찰하여 분자구조와 그것의 활성발현기구의 관계를 추정하는데 필요하다. 단백질의 1차구조는 다음과 같은 과정과 방법을 이용하여 알아낼 수 있다.
단백질의 1차구조를 결정할 때 우선 단백질의 분자량을 파악하고 단순단백질인 경우 구성 아미노산의 종류와 함유량 (아미노산 조성)을 조사한다. 아미노산 조성은 단백질을 산 또는 알칼리로 가수분해하여 이온교환 칼럼크로마토그래피 (column chromatography)를 이용한 아미노산 자동분석장치를 사용하여 조사한다. 아미노산 조성을 조사한 다음에는 고분자의 단백질을 비교적 저분자의 peptide(oligopeptide)로 분해하여 이들의 아미노산배열을 확인한다. 이 peptide들의 아미노산 배열 즉 일차구조로부터 peptide들이 단백질 분자 중에서 어떤 배열을 하고 있는가를 공통하는 아미노산배열 부분에서부터 조각 맞추기 퍼즐을 풀 때와 같이 추정적으로 나란히 늘어놓고 최종적으로 단백질 전체의 아미노산 배열을 결정하게 된다.
 |
| 그림 1 난백 lysozyme의 1차구조 모식도 |
2. Polypeptide의 부분분해
아미노산 배열을 결정하기 위해서는 단백질 분자를 부분적으로 절단하여 몇 개의 peptide로 만들어야 하며, 먼저 disulfide 결합을 산화반응으로 분해하여 절단한다. 그림 2에 나타낸 것처럼 disulfide 결합을 과의산(performic acid; H-CO-O-OH)으로 처리하면 이 결합은 산화 분해하여 cystine 잔기가cysteinic acid 잔기로 된 peptide가 얻어진다.
Polypeptide 사슬을 부분 가수분해하여 oligopeptide를 만드는 경우 어떤 특정한 아미노산 잔기 위치에서 가수분해 반응이 일어나도록 제한하여야 한다. 특정 아미노산 잔기가 관여하는 peptide 결합을 절단하는 화학반응은 많이 있으나 흔히 사용되고 있는 것은 그림 3에 나타낸 cyanogen bromide(Br-CN)에 의한 methionyl 결합의 절단이다. 산성조건하에서 Br-CN을 methionyl 결합에 반응시키면 methionine 잔기의 황원자가 시안화 되어 methylthiocyanide가 유리되고 iminolactone bromide가 생성되며 이것은 쉽게 가수분해되어 homoserine lactone이 된다. 그러므로methionine 잔기를 가진 단백질을cyanogen bromide로 처리하면methionine 잔기는homoserine 잔기로 되어 말단에 남게 된다.
Trypsin, chymotrypsin, pepsin, papain, subtilysin 등의 protease도 단백질을 oligopeptide로 분해하는데 이용된다. 이들 효소의 가수분해 위치는 각 효소의 특이성에 따라 비교적 일정하므로 고분자의 단백질을 일정한 말단 아미노산 잔기를 가지는 peptide로 분해할 수 있다.
3. N-말단 결정법
일반적으로 polypeptide 중의 아미노산 배열은 말단에서 결정한다. 다음에 N-말단 결정법을 설명한다. 그림 4에 나타낸 FDNB법(1-fluoro-2,4-dinitrobenzene)은 1945년 Sanger가 개발한 가장 고전적인 방법이다. 1-Fluoro-2,4-dinitrobenzene(FDNB)은 pH 8~9 실온이라는 온화한 조건하에서 peptide의 아미노기와 반응한다. Dinitrophenyl화한 peptide를 6N-HCl로 105℃에서 16시간 가수분해하면 N-말단 아미노산은 α-아미노기가 dinitrophenyl화한 유도체가 된다. Arginine 외의 N-dinitrophenyl 아미노산은 에테르로 추출할 수 있고 종이 크로마토그래피, 박층 크로마토그래피 등으로 표준 물질과 비교 확인할 수 있다.
Dansyl chloride법은 FDNB법과 마찬가지로 N-말단 아미노기를 표지 분자와 반응시키고 가수분해한 후 표지 분자가 붙은 아미노산유도체를 검출하여 확인하는 방법으로 그림 5에 과정을 나타내었다. Dansyl chloride를 peptide의 N-말단 아미노기와 반응시켜 sulfonamide 결합을 만든다. Sulfonamide 결합은 산 가수분해에 안정하므로 dansyl화 peptide의 가수분해물 중에서 N-dansyl 아미노산을 분리, 동정한다. N-dansyl 아미노산은 자외선을 조사하면 형광을 내므로 10-10~10-9mol에서 검출할 수 있다.
PTC(phenylisothiocyanate)법은 Edman법이라고도 하며 그 반응을 그림 6에 나타내었다. Phenylisothiocyanate(PTC)를 pH 8~9, 실온에서 peptide와 반응시키면 N-말단이 thiocarbamyl화 된 PTC-peptide가 얻어진다. 이것을 산성조건하, 예를 들어 trifluoroacetate(CF3COOH)와 반응시키면 N-말단 아미노산만 thiazoline 유도체로서 유리하고 나머지의 단백질부분은 분해하지 않고 남는다. Thiazoline 유도체는 이어서 환상구조를 만들어 PTH(phenylthiohydantoin)가 된다. PTH 아미노산은 ethylacetate로 추출하여 각종 크로마토그래피로 동정할 수 있다. 미분해로 남은 peptide 또는 단백질은 계속해서 다음의 N-말단 동정에 사용할 수 있다. 최근에는 이 일련의 반응을 자동화한 장치(peptide sequencer)도 시판되고 있으며 조건이 맞으면 N-말단으로부터 60 아미노산잔기 정도는 단기간에 배열을 결정할 수 있다.
4. C-말단 결정법
Hydrazine 분해법은 peptide를 hydrazine(NH2NH2)과 가열하여hydrazine 분해하면 C-말단 이외의 아미노산의 카르복시기는 hydrazide로 되지만 C-말단 아미노산만 유리의 아미노산으로 되므로 이것을 분리동정하는 방법이다. 그 외에 C-말단기의 선택적 tritium화 법이 있다. 이 방법은 C-말단 아미노산의 α위치의 수소를 선택적으로 방사성의 tritium(3H)으로 변환하고 가수분해 후 방사능으로 표지된 아미노산을 분리 동정하는 방법이다. 가수분해효소(peptidase)를 이용하는 법은 어떤 종류의 aminopeptidase 또는 carboxypeptidase가 peptide를 각각 N-말단 또는 C-말단으로부터 순차적으로 가수분해하는 성질을 이용하여 효소와 peptide를 반응시킨 후 생성된 아미노산을 순차 동정하면 N-말단 또는 C-말단부근의 아미노산 배열을 결정하는 방법이다. 그러나 아미노산의 종류에 따라 그 가수분해 속도가 다르므로 사용하는 효소의 각 아미노산에 대한 성질을 잘 검토하여 결과를 고찰할 필요가 있다.
5. 2차구조
Peptide 결합은 공명구조에 의해 이중결합성을 나타내므로 평면구조로 되어 peptide 결합의 C-N과 C=O는 동일 평면상에 있게 된다.(그림 7 참조) 그러므로 polypeptide 사슬에서 회전할 수 있는 부위는 N-Cα-C(C=O)의 단일결합의 결합축만이어서 peptide 사슬끼리의 정전결합이나 수소결합의 에너지, van der Waals' 힘이 극소치가 되도록 독특한 구조를 가지게 된다.
이때 peptide 사슬에서 peptide 결합의 carbonyl(>C=O)의 산소와 imide(-N-H)의 수소사이에서 수소결합한 결과 규칙적인 α-나선구조(α-helix structure)나 β-구조(β-pleated sheet structure)를 형성하며 이것을 2차구조라 한다.
- α-나선구조
α-나선구조는 peptide 사슬에서 한 아미노산의 -NH-와 4번째 아미노산의 >C=O 사이마다에서 나선축과 거의 평행으로 수소결합을 형성하여 우권(右卷)과 좌권(左卷) 2종류의 나선구조를 나타내게 된다. 천연의 단백질에서는 1회전에 3.6 아미노산 잔기가 들어가는 매우 안정한 우권(右卷) 나선형만을 가진다(그림 8 참조). 이 구조에서 각 아미노산 잔기는 나선에서 0.15nm의 높이를 차지하며 1회전의 높이는 약 0.54nm가 된다. α-나선구조를 많이 가지고 있는 단백질은 myosin, hemoglobin, fibrin, ferritin, 모발의 keratin 등의 섬유상단백질이며 이들을 α-단백질이라고 한다. α-나선구조에 있어서 친수성 아미노산 잔기의 R-기는 바깥쪽을 향하고 있고 소수성의 R-기는 안쪽으로 향하고 있다.
- β-구조
β-구조는 병풍구조(pleated sheet structure)라고도 하며 peptide 사슬들이 같은 방향으로 향하고 있는 평행형(parallel)과 반대방향으로 향하고 있는 역평행형 (antiparallel) 2가지 형태가 있다.(그림 9 참조) 이 구조에서는 한 peptide 사슬의 -NH-와 인접한 peptide 사슬의 >C=O 사이에서의 수소결합에 의하여 안정화되어 있으며 두 아미노산 잔기 사이의 간격이 평행한 것에서는 0.325nm, 역평행한 것에서는 0.351nm라는 것이 가장 큰 특징이다. 즉 완전히 펼쳐진 peptide 사슬에서 이 거리는 0.365nm이므로 β-구조는 약간 접혀져 있다는 것이다. 견사 fibroin, 면역 globulin, superoxide dismutase등은 β-구조를 가지며 이들을 β-단백질이라 한다.
 |
| 그림 9 단백질의 β-구조 |
- 3중나선구조
힘줄(腱), 인대(靭帶) 및 피부에 함유되어 있는 collagen은 3중나선구조를 가진다. Collagen의 기본단위는 분자량 290,000의 tropocollagen이다. 이것은 밧줄의 가닥처럼 나선상으로 꼬인 3개의 polypeptide 사슬(α1 사슬 2개, α2 사슬 1개)로 구성되어 있으며 1회전에는 3개의 아미노산 잔기가 있고 거리는 0.9nm이다.
Tropocollagen 분자는 (Gly-X-Y)의 배열이 반복되는 …(Gly-X-Y)n…의 구조를 가지고 있으며 보통 X와 Y의 아미노산은 alanine과 proline으로 되어 있다.(그림 10 참조)
2차구조에서 아미노산의 역할 단백질이 α-나선구조나 β-구조로만 되어 있는 경우는 거의 없고 전체 중에서 일부 영역에 이들의 구조를 포함하고 있다.(표 참조)
구상단백질 | 아미노산 잔기수 | α-나선구조 | β-구조 |
myoglobin lysozyme carboxypeptidase ribonuclease chymotrypsin | 156 129 307 124 247 | 78 40 38 26 14 | 0 12 17 35 45 |
표 단쇄 구상단백질의 α-나선구조와 β-구조의 함량(%)
예를 들면 lysozyme의 경우 전체에서 α-나선구조는 40%이고 β-구조는 12%이며 나머지 48%는 무질서한 구조(random coil)를 하고 있다. 이것은 바로 단백질의 1차구조, 즉 아미노산의 배열순서에 영향을 받기 때문이다. Peptide 사슬 내에서 glutamic acid, methionine, alanine, leucine 등의 아미노산이 많이 존재하는 부위는 α-나선구조를 잘 형성하고 valine, leucine, isoleucine, phenylalanine, tyrosine, tryptophan 등의 아미노산이 많이 존재하는 부위는 β-구조를 잘 형성한다고 알려져 있다. Glycine, proline, aspartic acid 등의 아미노산은 β-구조와 α-나선구조를 연결하는 부위에 존재하는 경향이 있다. 한편 proline은 α-나선구조나 β-구조가 연속되는 것을 차단하는 역할을 한다.
6. 3차구조
앞서 말한바와 같이 하나의 polypeptide 사슬은 각 영역의 1차구조에 따라 α-나선구조 또는 β-구조 그리고 무질서한 구조를 형성하고 이것이 서로 조합되어 구조적, 기능적으로 갖추어진 입체구조(conformation)를 3차구조라 한다.
 |
| 그림 11 단백질의 3차구조를 유지하는 결합양식 |
즉 3차구조는 일정한 아미노산 배열을 가진 polypeptide 사슬이 3차원적 공간에서 어떤 입체배위(stereoconformation)를 가지는가를 나타내는 것이다. 구상단백질의 경우 입체구조는 몇개의 구조단위(domain)로 나누어져 있으며 탈수소효소류에서는 보효소와 결합하는 domain과 촉매작용을 가진 domain을 가진다.
단백질의 3차구조는 그림 11에서 보는바와 같이 아미노산의 R-기 사이에 작용하는 수소결합, 정전결합(이온결합), disulfide(-S-S-) 결합, 소수성기 상호작용 등으로 안정화되어 있다. 그러나 peptide 사슬사이의 공유결합 이외의 결합양식은 그 결합력이 약하기 때문에 가열, pH 변화, 요소 등의 변성제, 유기용매, 계면활성제 등으로 단백질의 구조가 쉽게 변화하며 이것을 변성(denaturation)이라 한다. 그림 16에 myoglobin의 3차구조를 나타내었다.
7. 4차구조
단백질의 4차구조란 여러 개의 polypeptide 사슬이 소수결합, 수소결합, 정전결합 등의 비공유결합으로 회합하여 특정의 공간배치를 가지는 구조를 말한다. 각각의 polypeptide 사슬을 protomer 또는 subunit라 하고 이 회합체를 oligomer라 하며 protomer(subunit)의 수에 따라서 이량체(dimer), 삼량체(trimer), 사량체(tetramer)라 한다. 단백질이 4차구조를 가지는 것에 의해 한정된 유전정보로 거대한 구조단백질을 만들 수 있으며 protomer(subunit)의 상호작용으로 생물활성을 조절할 수 있다. 또 일련의 효소군이 복합체를 형성하는 것에 의해 중간체를 도중에 방출하지 않고 일련의 반응을 효율적으로 수행할 수 있다. 동일한 protomer로 구성된 회합체를 균일 4차구조라 하고 서로 다른 protomer로 구성된 회합체를 불균일 4차구조라 한다. Hemoglobin의 경우 2개의 α-protomer와 β-protomer로 된 불균일 4차구조를 가지며 α2β2로 표시되는 oligomer 단백질이다.(그림 13참조) 또 RNA polymerase나 F1-ATPase 등은 다수의 protomer로 되어 있다.
 |
| 그림 12 Myoglobin의 3차구조 |
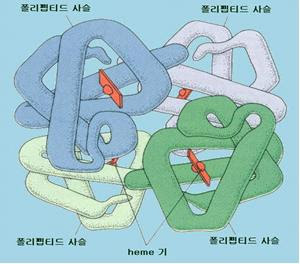 |
| 그림 13 emoglobin의 4차구조 |
- polypeptide 사슬 내에서 각종아미노산 잔기의 기능
Cysteine은 많은 단백질에서 disulfide(-S-S-) 결합에 관여하며 또 cytochrome C 등에서 thioether 결합을 형성한다. Histidine은 hemoglobin이나 cytochrome C에서 금속과 배위결합을 형성하거나 imidazole 1위치의 N-과 phosphoenolpyruvate 등의 인산이 결합하여 고에너지화합물을 형성한다. Lysine은pyridoxal phosphate, lipoate, biotin 등과 결합하거나 aldolase의 활성기로 된다. Serine은 chymotrypsin과 같은 serine proteinase의 친핵기가 된다. 또 phosphorylase a나 호르몬 감수성 lipase 등이 인산화 되어 활성화될 때 인산화 부위가 되며 acyl carrier protein에서는 인산 diester 결합을 형성한다. Glutamic acid, aspartic acid, arginine, lysine 및 histidine과 같은 극성아미노산은 polypeptide 사슬 내에서 정전결합에 관여한다. 그리고 glutamic acid와 aspartic acid는 ester 결합으로, serine은 O-glycosyl 결합으로 당단백질을 형성한다.










!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글