작용기의 종류와 성질 - 2
2. 이터류
이터류는 물분자에서 2개의 수소원자가 모두 알킬 또는 알릴기로 치환된 유도체로 생각할 수 있다. 물에서와 같이 산소원자를 중심으로 한 결합각은 105˚이다.
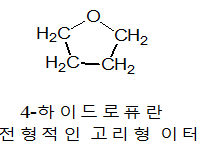
산소원자에 있는 두 쌍의 비공유 전자들과 2개의 결합전자쌍은 sp3혼성궤도함수를 차지한다. 이터는 Bronsted 염기 또는 Lewis 염기로 작용하지만 Bronsted 산이나 Lewis 산으로는 작용하지 않는다. 고리형 이터류는 그런대로 좋은 Lewis 염기이다. 왜냐하면 이들 이터 분자의 고리구조는 산소원자에 있는 전자쌍들을 보다 쉽게 상대방(전자쌍 수용체)에게 이용할 수 있도록 하기 때문이다.
3. 간단한 알테히드와 케톤류
알데하이드나 케톤류는 다같이 카르보닐기의 특성을 지닌다.가장 간단한 알데하이드는 포름알테히드, H2C=O인데,이것은 에틸렌분자와 같은 전자구조,즉 같은 수의 전자를 갖고 있으므로 이것과 유사한 전자 구조를 갖는다.이 포름알테히드의 구조를 분자궤도함수론적으로 표현하면 탄소 및 산소원자는 각각의sp2궤도함수 중2개는2개의 수소온자와σ결합을 형성하는데 사용된다.산소원자에 속하는sp2혼성궤도함수는 이 탄소원자와 공유된 전자쌍과2개의 비공유전자들로 채워지게 된다.혼성되지 않은p궤도함수들은 탄소원자에 하나,또 산소원자에 하나가 있고 이것들은 서로 결합하여 결합성π궤도함수를 형성한다(그림2).
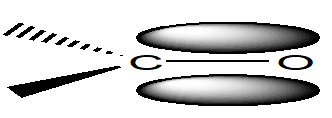 |
그림 2 포름알데하이드의 p 결합성 |
다른 알데하이드류는 포름알데하이드에 있는 1개 (그러나 2개 모두가 아님)의 수소원자가 하나의 유기군 R로 치환된 포름알데하이드의 유도체로 생각할 수 있다. 따라서 알데하이드의 일반식은 RCOH이다.
케톤류는 포름알데하이드의 2개의 수소원자가 모두 유기군 R로 치환된 포름알데하이드의 유도체로 생각할 수 있으며 RCOR로 나타낸다. 케톤에는 카르보닐기의 탄소 원자가 고리의 일부로 존재하는 고리형 케톤류도 있다. 탄소와 산소 사이의 전기음성도 차이로 말미암아 카르보닐기는 극성이 매우 크다.
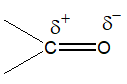
따라서 알데하이드와 케톤류의 쌍극자모멘트는 2~3D 로 비교적 크다. 케톤류 중에서도 특히 아세톤과 메틸에틸케톤은 공업적으로 중요한 용제이다. 알데하이드나 케톤류는 복잡한 유기화합물을 합성하는데 출발물질 또는 중간물질로서 유용하다.


!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글