실험 목적
1. 실험 목표
어떤 성분이 그 시료에 포함되어 있는지 알아내는 Ninhydrin정성 분석을 통해 단백질이 가지고 있는 구조 및 반응기에 따른 독특한 정색 반응을 살펴보고, 단백질의 함량을 알아볼 수 있는 정량 분석을 Biuret test를 이용한 분광법을 이용하여 단백질의 흡광도를 구하고 미지 시료 안의 단백질 농도를 확인해 보도록 한다.
실험 이론 및 원리
1. 실험 배경
단백질은 한 개 또는 두 개 이상의 polypeptide로 이루어진 고분자 물질이다. 아미노산이 peptide bond로 연결된 단백질의 1차 구조가 모여서 polypeptide를 이루고, 이것이 α-helix나 β-sheet등의 반복된 패턴을 보이는 것이 2차구조이며, 2차 구조를 이루는 polypeptide들이 소수성 상호작용이나 정전기적 상호작용, 수소결합, 공유결합등으로 3차원적 입체구조를 이루는 것을 단백질의 3차구조, 이런 3차 구조 여러 개가 모여서 만드는 고분자 단백질을 단백질의 4차 구조라고 한다. 그러나 모든 단백질이 4차구조인 것도 아니며, polypeptide와 단백질의 구분이 때때로 불분명할 때도 있다. 대부분의 단백질은 보통 두 개 이상의 폴리펩티드로 되어 있고 생물학적인 기능을 나타내며 독특한 형태를 가지나 polypeptide도 활성을 나타내고 형태를 갖추기도 한다. 단백질의 기능은 아미노산 서열 뿐 아니라 물리적 구조에 의해 결정된다.
단백질의 정성반응은 정색반응, 침전반응, 응고반응 등으로 나눌 수 있는데, 단백질의 정색반응은 단백질의 1차 구조를 이루는 peptide 결합 및 R group의 특수 원자단과의 반응에 의한 것이고, 무기염류 및 기타 침전제에 의한 침전반응과 열, 산 등에 의한 응고반응은 대부분 단백질 분자의 전하 또는 고차구조의 변화에 의한 것이다. 영양분이나 생물체를 구성하는 물질에 대한 정성 및 정량 분석을 통하여 어떤 영양소의 존재 유무나 함량을 조사할 수 있는데, 본 단백질 정성․정량분석에서는 Ninhydrin시험을, 정량 분석에서는 Biuret시험을 통한 분광법으로 단백질의 흡광도를 구하고 미지 시료 안의 단백질 농도를 확인해 보았다.
대부분의 아미노산은 amino group과 caboxyl group으로 인해 공통적인 반응을 나타낸다. 그 밖에 반응성이 큰 R group를 갖고 있는 아미노산은 독특한 반응을 보이는데, 특히 R group으로 인한 발색반응은 단백질의 구성아미노산의 식별과 정량에 이용된다. Ninhydrin과 아미노산과의 반응은 아미노산의 정성과 정량 분석에 특히 중요하며, Ninhydrin이 강력한 산화제이므로 α-아미노기를 산화하여 제거시킨다. 이 때 발생하는 암모니아는 환원된 Ninhydrin과 반응하여 자주색의 화합물을 생성한다. 이 생성물의 흡광도는 처음에 있던 아미노기의 양에 비례하므로 아민류의 정량에 이용할 수도 있다. α-아미노산, 펩타이드 및 단백질을 pH 4-8사이에서 Ninhydrin과 함께 가열하면 반응하여 대부분 청자색의 착색물질을 만든다. 착색물질의 색깔은 아미노산 종류에 따라 다르며, proline과 hydroxyproline은 청자색이 아닌 황색을 나타낸다.
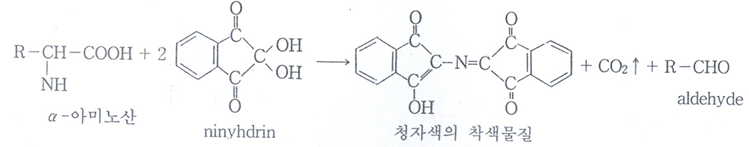 |
| 그림 1 Ninhydrin의 정색반응 |
Biuret은 알칼리성 용액에서 황산구리와 반응하여 보라색의 착화합물을 만든다. 두 개 이상의 펩타이드 결합을 가진 화합물도 마찬가지로 유사한 착화합물을 만들며, 단백질의 경우에는 청자색 또는 적자색을 나타낸다. 이 반응은 그림 2와 같은 착화합물을 나타내기 때문에 정색반응을 나타내며, peptide결합의 유무를 알기 위해 사용된다.
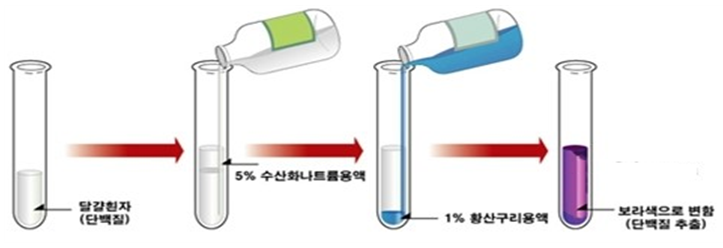 |
| 그림 2 Biuret 반응 |
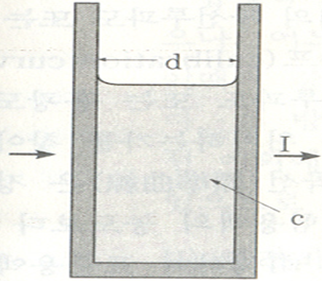
단백질 이외의 물질에서 이 발색반응이 일어나는 경우는 드물기 때문에 이 발색반응을 이용하면 시료 중의 단백질량의 정량을 할 수 있다. 발색한 용액의 흡광도를 파장 540-560㎚에서 측정하고 표준물질과 비교하면 시료 중의 단백질을 정량할 수 있다. 단색광이 일정한 두께의 용액을 통과할 경우, 입사광의 강도 I0와 투사광의 강도 I의 비는 용액에 따라 일정하다. 이것이 Lambert의 법칙인데 다음 식으로 나타낸다.

이 때 T를 이 용액의 투과도라 하며, (1)식으로부터
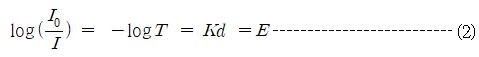
가 유도된다. 이 때  d는 용액층의 두께(㎝), K는 흡광계수라 부르는 파장과 용액의 고유 정수이다. 또한 투과도의 역수의 log값을 흡광도 또는 광학밀도라 하며 E 또는 A로 표시한다.
d는 용액층의 두께(㎝), K는 흡광계수라 부르는 파장과 용액의 고유 정수이다. 또한 투과도의 역수의 log값을 흡광도 또는 광학밀도라 하며 E 또는 A로 표시한다.
Beer는 많은 유색물질의 희박용액에 대하여 관찰해본 결과 일정 파장의 광선에 대해서 그 흡광계수 K는 이 용액의 농도 c에 비례한다는 사실을 발견하였다. 따라서 (2)식은 다음과 같이 나타낼 수 있다.
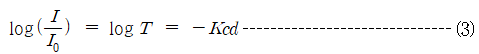
(3)식이 Lambert-Beer의 법칙을 나타낸 것이다. 이 때 K는 파장과 용액의 성질에 관계가 있는 정수인데, 만약 I와 d가 일정하고 파장과 용액이 일정하면 K도 일정하다.
E(A) = Kcd ........(4)
즉, 용액을 일정한 두께의 용기에 넣어 용액층의 두께(d)를 일정하게 하여 흡광도를 측정하면 용액 중 착색물질의 농도(c)에 비례하므로 흡광도를 측정하면 이 값으로부터 농도를 구할 수 있다.
 |
| 그림 3 비색분석법의 원리 |
실험 기구 및 시약
1. Ninhydrin test
1) 시험관대, 알콜램프, 시험관, 시험관집게, 스포이드, 피펫
2) glycine 0.1% 수용액, tyrosine 0.1% 수용액, tryptophan 0.1% 수용액, proline 0.1% 수용액
3) 알부민 1% 수용액, glucose 0.1% 수용액, 1% 암모니아수, Ninhydrin 0.2% 수용액
2. Biuret test
1) 분광 광도계, cuvette, vortexer, 폐액통, Kim wipes, 증류수, 휴지, 시험관대, 시험관
2) 피펫, 피펫 필러, 3.0 ㎎/㎖ Bovine serum albumin 10 ㎖, 뷰렛 시약, 탈지우유 50배 희석액
실험 방법
1. Ninhydrin test(정성분석)
1) 아미노산- glycine , tyrosine , tryptophan , proline 0.1% 수용액
2) 단백질 - 알부민 1% 수용액
3) glucose 0.1% 수용액
4) 1% 암모니아수
5) ninhydrin 0.2% 수용액(쓰기 바로 전에 만들 것)
6) 시험관에 1㎖ 시료 용액을 취하여 (한 시험관에 한 가지 용액만 선택하여서 넣을 것) 암모니아수 1-2 방울을 넣어 그 pH를 대햑 중성으로 조절한 후 ninhydrin용액을 5방울 정도 가하여 2분간 끓이면서 색의 변화를 관찰한다.
2. Biuret test
1) 정성분석
2% 알부민 용액 2㎖와 10% NaOH용액 2㎖를 잘 섞은 후 0.1% CuSO4 용액 1방울을 가하여 혼합한다. 이 때 핑크색이나 보라색은 나타나지 않는다. 계속해서 황산구리 용액 몇 방울을 가하여 핑크색에서 보라색이 될 때까지 (최고 20방울) 가한다. casein과 pepton용액으로 실험을 반복해 본다.
2) 정량분석
단백질 표준용액 : 3.0 ㎎/㎖ Bovine serum albumin 10 ㎖
뷰렛 시약 (총 500㎖) : CuSO4․5H2O 1.5g, 타르타르산 나트륨칼륨 4.5g을 250㎖의 0.2N NaOH 용액에 용해시키고 여기에 KI 2.5g을 추가한 후에 0.2N NaOH용액으로 총 500㎖의 부피로 만듦
시료 : 탈지우유 50배 희석
시험관 번호 | 시험관 1 | 시험관 2 | 시험관 3 | 시험관 4 | 시험관 5 |
내용물(㎖) | 물3 | 표준용액 3 | 물 2 + 표준용액 1 | 물 1 + 표준용액 2.0 | 시료3 |
3. 단백질의 정량
준비한 시료에 뷰렛 시약 3㎖를 가한 후 (총6㎖), 30분간 방치하였다가 540㎚에서 흡광도 측정


!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글