이성질체
분자식은 같으나 구조나 성질이 다른 화합물을 이성질체라고 한다.
이성질체의 종류
1. 구조이성질체
분자식은 같으나 구조가 다른 화합물을 말한다.
① C4H10(butane)의 구조 이성질체

② C5H12(pentane)의 구조 이성질체

|
2. 작용기 이성질체
분자식은 같으나 작용기가 서로 다른 이성체를 말한다. 예를 들면 C2H6O로 분자식이 표현되는 경우에는 C2H5OH의 에탄올과, CH3OCH3인 디메틸에테르가 있다 .
3. 기하 이성질체
시스, 트랜스 이성질체라고도 하며, 탄소원자에 결합된 원자단의 공간적 위치 차이로 생기는 이성질체이다.
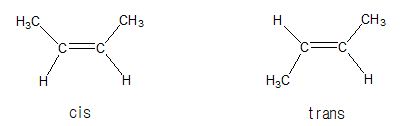
| |
cis 이성질체는 이중 결합을 사이에 두고 큰 치환기가 같은 면에 배열되어 있으며, trans 이성질체는 이중 결합을 사이에 두고 큰 치환기가 대각선으로 배열되어 있는 이성질체이다.
4. 위치 이성질체
분자식은 같으나 작용기의 위치가 다른 이성질체이다.
① C4H8의 위치 이성질체

② C3H8O 의 위치 이성질체

5. 광학 이성질체
탄소에 결합되어 있는 4개의 원자나 작용기는 같으나 그 화합물의 거울상과 서로 포개어지지 않을 때, 이 거울상을 광학 이성질체라고 한다. 광학 이성질체는 편광의 편광면을 회전시키는 능력이 있으며 광학 이성질체를 찾는 방법은 중심 탄소주위에 결합되어 있는 4개의 원자나 원자단이 모두 다르면 광학 이성체가 존재하는 것이고, 하나라도 같으면 광학 이성체가 없는 것이다.

유기화학의 개요
탄소를 기본 골격으로 하여 H, O, N, S, P, 할로겐 등이 결합되어 만들어진 물질로, 예전에는 유기체 내에서만 만들어진다고 생각하여 유기 화합물이라고 불렀으나 1828년 독일의 뵐러가 무기물에서 유기물을 최초로 합성하여 유기 화합물이라는 의미가 없어져 탄소 화합물로 부르게 되었다.
NH4CNO → (NH2)2CO


!&emoji=☕&slug=xFu35q9&button_colour=5F7FFF&font_colour=ffffff&font_family=Poppins&outline_colour=000000&coffee_colour=FFDD00)



![[일반생물학실험]온도와 pH가 효소작용에 미치는 영향 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdvNA5S925m8lScjFhJj-uy5SdCcaNFG1AuR_7BbQbDEoHBDEEkqfM64sipvro3RydmSO4_MS2794o2bJ0FCljQ31pcD5W39ZGOHROD7qKXLO1rlm2ZuBtbxJ9CZHSnsk2v1KSEsL4EGA/w680/%25EC%2598%25A8%25EB%258F%2584%25EC%2599%2580+pH%25EA%25B0%2580+%25ED%259A%25A8%25EC%2586%258C%25EC%259E%2591%25EC%259A%25A9%25EC%2597%2590+%25EB%25AF%25B8%25EC%25B9%2598%25EB%258A%2594+%25EC%2598%2581%25ED%2596%25A5.PNG)
![[일반생물학실험]여러 조건에 따른 효소 반응](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj4kaETe9N8j9q9-ClYy9V1kM2L9s5l19K6YoBOE0SB70BmssQXzVADvQijp1ieiQ9mIxcmCwz9e-YCQFVnXYR7m1vmfjTSs0ZNxCmBLG7wgzRBqiY1Kizx8YuhSdw-RDbs1PohokUd69c/w680/%25EC%2597%25AC%25EB%259F%25AC+%25EC%25A1%25B0%25EA%25B1%25B4%25EC%2597%2590+%25EB%2594%25B0%25EB%25A5%25B8+%25ED%259A%25A8%25EC%2586%258C+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반생물학실험]항생제 감수성 검사 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwCJEjB_r2Ojsrn244q-fQmpHsDyUUfgWMUnsfhPKQeN2e7_u1pN_ZuwIdxPLVWS6LFywJUrDTYWJe2V6ZVVb1PtfyvX62Y15OxPfXoiaJkqVoSir3ZoFAmDpe5GcoMBmxEsJUKsSvWYc/w680/%25ED%2595%25AD%25EC%2583%259D%25EC%25A0%259C+%25EA%25B0%2590%25EC%2588%2598%25EC%2584%25B1+%25EA%25B2%2580%25EC%2582%25AC.PNG)
![[고분자공학실험]PMMA 중합 반응 - MMA, AIBN 정제와 PMMA Bulk 중합 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj5hkRZhYWcXolP679_yO0kyP8_R-G9dlTqk5AGEdfsIq9M5K3DJc_tvpYck4x1kciBm2IWwFygrzfWH-HPzUjXiCHAFrjv9zeKYDxAl2tGNqgryyc3t9y4B9lQveS_coAqnmZw4pX4Hyo/w680/PMMA+%25EC%25A4%2591%25ED%2595%25A9+%25EB%25B0%2598%25EC%259D%2591.PNG)
![[일반화학실험]산화-환원 적정 : 비타민 C의 정량 1부](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintFUW1pYHbKK8MPzki4vdqVMjTUEFFxPdZB1sTJQw13XSFZWqcN5w0x1AlyzfErlYYSgoNqBni4YGlpFC4ZeULK9VHbhfIXLiuZ3UWTl2oBRua7FE8UUQqtYEx3498FENAnlHlh0f8RFkT7Na8jveOtBtQ5UbY8jE80ZCwFoU_jqw_0Z6BofRYZF7/w680/%EC%82%B0%ED%99%94-%ED%99%98%EC%9B%90%20%EC%A0%81%EC%A0%95%20-%20%EB%B9%84%ED%83%80%EB%AF%BC%20C%EC%9D%98%20%EC%A0%95%EB%9F%89.PNG)
0 댓글